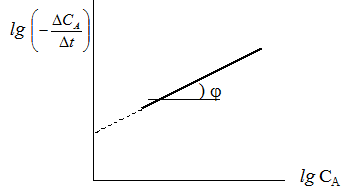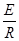Методы определения порядка реакций
Лекция 31
Методы определения порядка реакций. Влияние температуры на скорость реакции : правило Вант-Гоффа, уравнение Аррениуса, энергия активации и ее экспериментальное определение.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОРЯДКА РЕАКЦИЙ.
Для определения порядка реакции в целом необходимо сначала установить порядок реакции по каждому веществу, вступающему в реакцию. Сумма порядков реакции по каждому веществу дает порядок реакции в целом. Чтобы определить порядок реакции по данному веществу, необходимо создать такие условия, при которых в процессе реакции изменялась бы концентрация только этого вещества. Для этого концентрации всех остальных участников реакции должны быть настолько большими, чтобы изменением их во времени можно было пренебречь и значения этих концентраций можно было ввести в константу скорости. Тогда для реакции
n1 A + n2 B + n3 C = n4 D + n5 E
протекающей при V = const, можно записать:
–  = k1
= k1  , где k1 = k
, где k1 = k 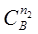
 (1)
(1)
Порядок реакции по данному веществу можно определить следующими способами:
1. По времени полураспада (см. «Необратимые реакции n-го порядка). Время полураспада t обратно пропорционально a n-1. Проводят несколько опытов с разной исходной концентрацией данного вещества. Этот метод особенно удобен для определения порядка реакций, протекающих между газообразными веществами.
Рекомендуемые материалы
2. Проводят реакцию так, что берут все вещества, кроме одного (скажем, А) в избытке. Реакцию проводят дважды, задаваясь разными начальными значениями концентрации. Тогда можно записать два уравнения скорости:
–  = k1
= k1  ; –
; –  = k1
= k1 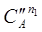
Разделим уравнения друг на друга и прологарифмируем:
 =
=  ; lg (¶C¢A /¶t) – lg (¶C¢¢A /¶t) = n1 (lg C¢A – lg C¢¢A)
; lg (¶C¢A /¶t) – lg (¶C¢¢A /¶t) = n1 (lg C¢A – lg C¢¢A)
n1 = 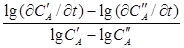
Дифференциалы заменяем конечными разностями:
n1 = 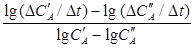
Это уравнение и позволяет определить порядок реакции по веществу А. Для этого надо определить изменение концентраций DC¢A и DC¢¢A за время Dt , задавая разные исходные концентрации вещества А, а концентрации всех остальных веществ выбирая очень большими. Значения C¢A и C¢¢A , входящие в знаменатель, нужно брать средними для данного промежутка времени.
Аналогично определяют порядки реакций по другим веществам.
3. Порядок реакции можно определить графически из уравнения (1):
|
| tg j = n1 Для построения такой кривой необходимо опытным путем определить среднюю скорость реакции (– DСА /Dt) и концентрацию вещества А в каждый момент времени. |
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ РЕАКЦИИ.
В общем случае скорость химической реакции с повышением температуры увеличивается. Правило Вант-Гоффа : при повышении температуры на 10оС скорость реакции возрастает в 2–4 раза. Для характеристики зависимости скорости химической реакции от Т был введен температурный коэффициент скорости реакции g : g = 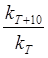
(kT+10 и kT – константы скорости химической реакции при температуре Т+10 и Т).
В среднем этот коэффициент равен 3. Следовательно, при изменении Т на 100оС скорость реакции изменяется в 310 или 59049 раз. Пользуясь температурным коэффициентом скорости реакции, можно рассчитывать константы скоростей при различных Т. Для этого прологарифмируем вышеприведенное выражение:
lg kT+10 – lg kT = D lg k = lg g / : DT = 10o
 =
= 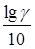
Если считать, что в пределах 10о температурный коэффициент остается постоянным, можно записать:
 =
= 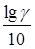
После интегрирования:  =
=  (T2 – T1)
(T2 – T1)
где  – средний температурный коэффициент в интервале температур Т2 – Т1.
– средний температурный коэффициент в интервале температур Т2 – Т1.
Такая оценка зависимости скорости реакции от Т носит весьма приближенный характер и имеет малую практическую ценность. Более обоснованную зависимость константы скорости реакции от Т можно получить с помощью уравнения изохоры или изобары химической реакции. Без индексов, характеризующих условия протекания процесса, уравнения изохоры и изобары запишутся одинаково:
 =
= 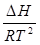
где К = k1 / k2 – константа химического равновесия; k1 и k2 – константы скоростей прямой и обратной реакций; DН – теплота химической реакции.
 =
=  =
= 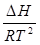
Запишем тепловой эффект как разность двух величин:
DН = Е1 – Е2
 –
–  =
=  –
– 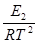
С точностью до постоянной величины В можно считать, что слагаемые правой и левой части попарно равны друг другу:
 =
=  + В ;
+ В ;  =
= 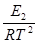 + В
+ В
Опыт показал, что В = 0. Поэтому в общем виде можно записать:
 =
= 
Это уравнение называется уравнением Аррениуса и характеризует зависимость константы скорости химической реакции от Т. Величина Е имеет размерность энергии и носит название энергии активации. Энергию активации можно определить как тот избыток энергии по сравнению со средней энергией молекул при данной Т, которой должны обладать молекулы, чтобы они могли вступить в химическую реакцию.
Проинтегрируем уравнение Аррениуса, считая, что Е – величина постоянная:
ln k = –  + ln C
+ ln C
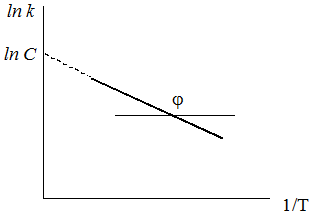
(ln C – константа интегрирования). Величину Е можно определить из графика:
|
| tg j = – Потенцируя вышеприведенное выражение, получим: k = C e– E /RT Из этого уравнения видно, что константами, характеризующими реакцию, являются предэкспоненциальный множитель С и энергия активации Е. Чем больше Е, тем меньше скорость химической реакции. |
Если уравнение Аррениуса проинтегрировать в пределах от Т1 до Т2, то получим:
 =
= 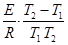
Рекомендация для Вас - Неофрейдистская концепция Эриха Фромма.
(k2 – константа скорости химической реакции при Т2, k1 – то же при Т1). Т.о., зная величину константы скорости реакции при одной Т, можно вычислить ее величину при другой Т.
|
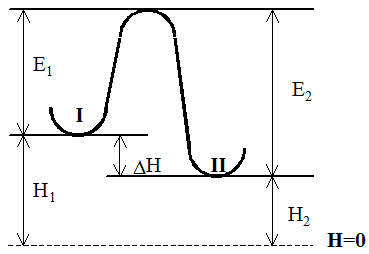
| Связь энергии активации с тепловым эффектом реакции можно проиллюстрировать с помощью представления об энергетическом барьере. Химическую реакцию можно представить как переход системы из энергетического состояния I в энергетическое состояние II, сопровождающийся теплотой DН. Из рис. видно, что переход из состояния I в состояние II возможен при затрате энергии Е1; обратный переход возможен при затрате энергии Е2. |
При осуществлении реакции в прямом направлении выделяется количество энергии – DН = Е2 – Е1
Величина  равна (по закону Гесса) разности энтальпий исходных и конечных продуктов реакции – DН = Н1 – Н2 ,
равна (по закону Гесса) разности энтальпий исходных и конечных продуктов реакции – DН = Н1 – Н2 ,
отсчитываемых от некоторого исходного значения, принятого за нулевое (Н = 0).