Предельные ациклические углеводороды (алканы)
2.2. Предельные ациклические углеводороды (алканы)
Предельные углеводороды (алканы) – это углеводороды, в молекулах которых атомы углерода связаны между собой одинарными связями, а все остальные единицы валентности насыщены атомами водорода.
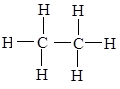
Общая формула алканов СnН2n+2, где n ≥ 1. Например, СН4 – метан, С2Н6 – этан, С3Н8 – пропан и т. д. В этом ряду каждый член ряда отличается от своего соседа на атомную группу СН2, которая называется гомологической разностью, сам ряд – гомологическим рядом, а члены ряда – гомологами. В табл. 2.1 приведен гомологический ряд метана.
Таблица 2.1
Гомологический ряд метана
Для названия органических соединений широко используют две номенклатуры: рациональную и систематическую (ИЮПАК). По рациональной номенклатуре углеводороды рассматриваются как производные метана. Например:
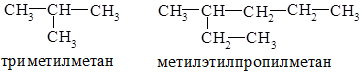
Согласно систематической номенклатуре за основу принимают наиболее длинную цепь углеродных атомов и нумеруют их с того конца, к которому ближе стоит углеводородный радикал, а затем называют номер углеродного атома, с которым связан радикал, затем радикал и углеводород, которому соответствует длинная цепь. Например:
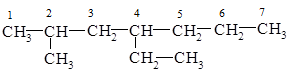
2-метил-4-этилгептан
Для алканов характерна изомерия углеродного скелета. Первые три члена гомологического ряда алканов изомеров не имеют, а четвертый – бутан имеет два изомера:
 СН3—СН2—СН2—СН3
СН3—СН2—СН2—СН3
бутан
2-метилпропан (изобутан)
У пентана – 3 изомера, у гексана – 5 и т. д.
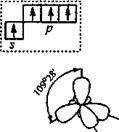
Строение молекул метана и его гомологов показаны на рис. 2.2 и 2.3, а характерные физические и химические свойства, способы получения и области применения алканов приведены в табл. 2.2.
| sp3-гибридизация
С*...2
атома углерода
структурная формула |
Рис. 2.2. Строение молекулы метана и его структурная формула
| С2Н6 – этан
структурная формула
структурная формула
|
Рис. 2.3. Строение гомологов метана – этана и пропана и их
структурные формулы
Таблица 2.2
Свойства, способы получения и области применения алканов
| Физические свойства | Химические свойства | Способы получения | Области применения | |||
| Метан СН4 – газ без цвета и запаха, в 1,8 раза легче воздуха, малорастворим в воде. Этан, пропан, бутан – также газы. Пентан, гексан и далее – жидкости. Углеводороды, начиная с С17Н36 – твердые вещества. Жидкие и твердые алканы легче воды и нерастворимы в ней. По мере роста числа атомов углерода возрастают плотность, температуры плавления и кипения алканов. | 1. Реакции замещения: CH4 2. Реакции нитрования и сульфирования: a)CH4+HNO3 нитрометан б)CH4+ H2SO4 метансульфокислота 3. Реакции окисления (горения): СН4 + 2O2 4. Реакции неполного окисления: алкан 5. Реакции термолиза: а) 2СН4 б) СН4 6. Реакции дегидрирования: CH3–СН3 7. Реакции изомеризации: СН3–СН2–СН2–СН2–СН3
изопентан | 1. Получение метана: а) в лаборатории: CH3COONa + NaOH Аl4С3 + 12Н2O б) в промышленности: С + 2Н2 СО + 3Н2 2. Общие способы получения алканов: а) СnН2n + Н2 б) СН2=СН2 + Н2 в)С2Н5Вr+2Na+C2H5Br г)C2H5COONa+ NaOH 3. Пропан, пентан, бутан, получают из природных горючих и попутных нефтяных газов и газов нефтепереработки. Гексан получают из легких фракций нефти и из смеси продуктов, образующихся в реакции Фишера – Тропша. | 1. В качестве топлива, в том числе для двигателей внутреннего сгорания. 2. В органическом синтезе для получения хлорпроизводных, метилового спирта, формальдегида, органических кислот. 3. Для получения непредельных углеводородов, водорода и сажи методом дегидрирования. |
Предельные (насыщенные) углеводороды с открытой цепью называют парафинами. В отличие от парафинов предельные циклические углеводороды с замкнутой цепью называют циклопарафинами, нафтенами или циклоалканами. По строению циклопарафины отличаются от парафинов тем, что они содержат замкнутые цепи из трех, четырех, пя ти, шести и более атомов углерода. Их общая формула СnН2n (n≥ 3):
ти, шести и более атомов углерода. Их общая формула СnН2n (n≥ 3):
циклопропан циклопентан циклогексан
Некоторые свойства, способы получения и области применения циклопарафинов приведены в табл. 2.3.
Таблица 2.3
Свойства, способы получения и области применения циклических углеводородов
(циклопарафинов)
| Физические свойства | Химические свойства | Способы получения | Области применения | |||||||||||||||
| Циклопропан С3Н6, циклобутан С4Н8, циклопентан С5Н10, циклогексан С6Н12– жидкости, плохо растворимые в воде, но легко растворимые в органических растворителях. В природе содержатся в составе некоторых сортов нефти, в частности в легком бензине. Устойчивость циклов возрастает от С3 к С6, а затем до С12 – понижается. | 11. Реакции гидрирования:
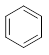
+ Н2 циклобутан бутан 2. Реакции дегидрирования:
циклогексан бензол 3. Реакции горения на воздухе: а) 2С3Н6 + 9О2 б) С4Н8 + 6О2 в) С6Н12 + 9О2 4. Реакция галогенирования:
+ Br2 5. Реакция гидрогалогенирования:
+ HCl | 1. Из галогенпроизводных:
+ 2Na
б) Cl(CH2)4Cl +Zn 2. Циклогексан получают гидрированием бензола:
+ 3Н2 или декарбоксилированием циклогексанкарбоновой кислоты:
+ 2NaOH
3. Циклопентан можно получить гидрированием циклопентандиена (а) и восстановлением циклопентанола (б):
Ещё посмотрите лекцию "3 История развития человеческого общества и проблемы экологии человека" по этой теме. + 2Н2
+Н2 | 1. Циклопропан при-меняется как средство для наркоза. 2. Циклопентан используется как растворитель для простых эфиров целлюлозы. 3. Циклогексан при-меняется как растворитель и экстрагент, а также для получения циклогексанола. |



 sp3- гибридизованные орбитали тетраэдр
sp3- гибридизованные орбитали тетраэдр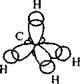
 СН4 – метан
СН4 – метан 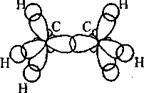
 С3Н8 – пропан
С3Н8 – пропан CH3Сl
CH3Сl  CH2Сl2
CH2Сl2 CH3NO2+ H2O
CH3NO2+ H2O спирт
спирт  СН2=СН2 + Н2
СН2=СН2 + Н2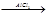
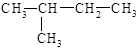
 а) С3Н6 + Н2
а) С3Н6 + Н2 
 + 3Н2
+ 3Н2 
 а)
а)  б)
б)
 а)
а)