Растворы электролитов
Растворы электролитов
Электролиты - вещества, которые в воде диссоциируют на ионы.
Существует три класса электролитов:
· кислоты
· гидроксиды
· соли.
Растворы электролитов имеют две особенности по сравнению с растворами неэлектролитов:
· проводят электроток,
· подчиняются законам Рауля и Вант - Гоффа с определёнными отклонениями.
Обе особенности растворов электролитов объяснила гипотеза шведского учёного Сванте Аррениуса (1883 г).
Рекомендуемые материалы
Гипотеза Аррениуса сводилась к тому, что вещества неидеальных растворов, то - есть то, что сейчас называется растворами электролитов, в воде диссоциируют на ионы.
Поскольку неидеальные растворы проводили электроток, то их называли растворами электролитов.
Для растворов электролитов в математические выражения законов Рауля и Вант - Гоффа был введён поправочный коэффициент. Ввёл его Вант - Гофф и назвал его изотоническим коэффициентом.
i - поправочный коэффициент (изотонический коэффициент).
Законы Рауля для растворов электролитов:
ΔP / РА = i NB,
Δt0кипения =i Кэ См,
Δt0замерзания = i Кк См.
Закон Вант - Гоффа для растворов электролитов:
Росмотическое = i RTCB
| Раствор неэлектролита | Раствор электролита | |
| CB = 1 моль / л | CB = 1 моль / л | |
| С12H22O11 | NaСl= Na++Cl- | |
| Сахар в воде диссоциирует | Соль в воде диссоциирует | |
| на молекулы | на ионы | |
| 1 моль молекул | 1 моль Na+ | |
| Частиц будет больше | ||
| в 2 раза | ||
| Al(NO3)3=Al3++3NO-3 | ||
| Al(NO3) = Al3+ + 3NO-3 | ||
| (в 4 раза больше) | ||
| 1) 1< i <2 | ||
| 2) 1< i <4 |
Физический смысл изотонического коэффициента состоит в том, что он учитывает увеличение количества частиц в растворе электролита по сравнению с раствором неэлектролита той же концентрации.
Степень диссоциации электролитов
Все электролиты диссоциируют на ионы, но в количественном отношении диссоциируют по - разному.
Количественной характеристикой диссоциации электролитов является степень диссоциации.
Степень диссоциации: λ= n/N (доли ед.),
где
· n - количество молекул данного электролита, которые продиссоциировали на ионы;
· N - общее количество молекул данного электролита в растворе.
Если степень диссоциации превышает 30%, электролит относится к сильным,
если  , то данный электролит является слабым.
, то данный электролит является слабым.
И.А. Каблуков объяснил механизм диссоциации электролитов в воде на ионы.
Электролиты диссоциируют на ионы в воде по двум механизмам:
· Ион - дипольный механизм.
· Диполь - дипольный механизм.
Рекомендуем посмотреть лекцию "54 Деревянные сооружения мусульманской архитектуры".
По ион - дипольному механизму диссоциируют на ионы те электролиты, которые имеют ионное строение. Когда электролит, имеющий ионную решетку, попадает в воду, то краевые ионы решетки начинают притягивать к себе молекулы воды и гидратируются ими. Под влиянием всевозможных видов движения гидратированные ионы отрываются от решетки и уходят в раствор. Процесс продолжается до полной диссоциации кристалла на ионы.
Ион - дипольный механизм относится к диссоциации сильных электролитов.
Диполь- дипольный механизм
И электролит, и вода являются диполями. Два диполя притягиваются друг к другу, взаимно усиливая диполи. Оба полюса молекулы электролита оказываются гидратированными молекулами воды. Затем происходит полный разрыв молекулы электролита. В конечном итоге картина та же самая: гидратированные ионы уходят в раствор, рис.1.
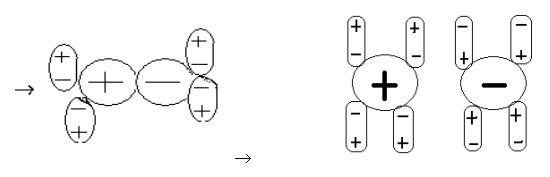
Рис.1




















