Глава 03 -Смеси идеальных газов (1062503)
Текст из файла
Глава III. СМЕСИ ИДЕАЛЬНЫХ ГАЗОВ
§ 14. Общие сведения. Закон Дальтона
В практике очень редко используют однородные газы как рабочие тела. Чаще применяют смеси, состоящие из нескольких однородных газов. Каждый из газов, входящих в смесь, называют компонентом. Например, рабочим телом двигателей внутреннего сгорания и газовых турбин служат продукты сгорания различных топлив, представляющие собой смесь азота N2, углекислого газа С02, окиси углерода СО, кислорода 02 и некоторых других газов. Продукты сгорания топлива в топках котельных установок также являются смесью тех же газов. Поэтому очень важно установить методы исследования газовых смесей и, в частности, необходимо знать уравнение состояния смеси.
Рассмотрим смеси газов, в состав которых входят компоненты, подчиняющиеся уравнению состояния газа, т. е. смеси идеальных газов.
Для исследования свойств смесей газов большое значение имеет закон, открытый известным английским физиком-химиком Дальтоном (1766—1844 гг.). Закон формулируется так: если смесь состоит из газов, которые не вступают между собой в химические реакции, то каждый»газ ведет себя так, как будто он один занимает весь объем, в котором находится смесь. Молекулы каждого газа распределены равномерно по всему объему смеси.
Из этого закона следует, что каждый газ, находящийся в смеси, оказывает на стенки сосуда, в котором заключена смесь, такое Давление, какое он оказывал бы, занимая сам весь объем сосуда. Такое давление называют парциальным. Давление смеси равно сумме парциальных давлений компонентов:
р1 ,р2 ,рп — парциальные давления отдельных компонентов смеси.
Состав смеси может быть задан массовыми или объемными долями. Иногда смесь задают также числом киломолей компонен-тов
23
Отношения
называют массовыми долями первого, второго и т. д. газов, входящих в смесь.
В этих отношениях те т1 ,т2...тп — массы отдельных газов, входящих в смесь;
mсм— масса смеси газов.
Очевидно, что
Отношения
Согласно уравнению (31) можно записать
называют объемными долями первого, второго и т. д. газов, входящих в смесь. В этих отношениях V1, V2 ... Vn — объемы отдельных газов, входящих в смесь, взятых при давлении и температуре смеси, называют приведенными или парциальными объемами данных компонентов.
Возьмем такое число RCM, которое при умножении отдельных компонентов на сумму масс m1 + т2 + … + тп дает произведение, численно равное выражению в скобках правой части уравнения (37). Введенное на основе формальных соображений в уравнение (38) число Rc „ можно назвать газовой постоянной смеси.
Так как
где т — масса смеси, уравнение (40) принимает следующий вид:
Для вычисления приведенных объемов воспользуемся законом Бойля — Мариотта. Напишем его для всех газов, входящих в смесь:
откуда можно найти приведенные объемы компонентов:
Из уравнений (35) видно, что
§ 15. Уравнение состояния смеси
Имеется смесь из п газов, подчиняющихся уравнению состояния газа. Смесь занимает объем V при давлении р и температуре Т.
Основываясь на законе Дальтона, можно для каждого газа написать уравнение состояния:
В этих уравнениях R1, R2 ... Rn — газовые постоянные отдельных газов. Просуммировав уравнения (36), получаем
Выражение в скобках можно представить следующим образом:
уравнение (37)
Поясним уравнения (35). Пусть, для простоты, смесь состоит из двух газов. Объем смеси VCM, давление рсм, температура ТСм.
Удалим из смеси один из газов, например, химическим поглощением; в результате давление понизится и будет равно парциальному давлению pv оставшегося газа. Температура и объем изменяться не будут. Теперь сжатием при постоянной температуре, равной температуре смеси газов, увеличим давление р1 до давления рсм, которое имела смесь. Полученный объем и будет искомым приведенным объемом оставшегося газа.
Это и есть уравнение состояния смеси. Для его использования теперь нетрудно определить газовую постоянную смеси из уравнения (39):
Так как
![]() то
то
![]()
25
окончательно
Ниже будет приведено выражение для газовой постоянной смеси через объемные доли.
Очевидно, газовая постоянная смеси RCM имеет ту же размерность и тот же физический смысл, что и газовая постоянная однородного газа.
Если ввести некоторое условное значение молекулярной массы см, определяемое молекулярными массами отдельных компонентов и содержанием их в смеси, то и для смеси газовую постоянную можно вычислить по уравнению (29):
где см — некоторое условное понятие молекулярной массы (см называют кажущейся молекулярной массой). Ее условность состоит в том, что в смесь входят различные газы и каждый имеет свою молекулярную массу.
§ 16. Формулы для расчета смесей
Между массовыми и объемными долями существует зависимость, которую для любого газа, входящего в смесь, например для п-ного, можно получить следующим образом:
но
тогда
Плотности компонента и смеси, т. е. n и см, должны быть взяты при давлении и температуре смеси.
По закону Авогадро плотности различных газов прямо пропорциональны молекулярным массам.
На основании предыдущего для данного случая можно написать
тогда
Эти соотношения справедливы для любого газа, входящего
в смесь.
Рассмотрим способ определения состава смеси через числа киломолей компонентов. Пусть смесь состоит из п газов; тогда приведенные объемы каждого из них можно выразить числом киломолей, т. е.
— объемы киломолей соответствующих газов при давлении и температуре смеси;
К1, К2, Кп — их числа киломолей. Объем смеси газов также можно выразить числом киломолей,
т. е.
где Кcм — число киломолей смеси, равное частному от деления массы смеси на кажущуюся молекулярную массу смеси. На основании уравнения (33) можно написать
Учитывая, что объем киломолей для всех газов, в том числе и для смеси, при одинаковых параметрах есть величина постоянная, последнее уравнение можем переписать в виде
и по аналогии
Зная, что сумма объемных долей равна единице, а также принимая во внимание уравнение (44), можно написать
Таким образом, задание смеси числом киломолей равносильно заданию ее объемными долями.
27
Просуммировав все эти уравнения, получаем
тогда
откуда
По уравнению (46) можно определить кажущуюся молекулярную массу смеси, если она задана объемными долями.
Использовав уравнение (43) и проведя аналогичные действия, можно получить зависимость cm от массовых долей:
Газовую постоянную смеси, как уже указывалось, можно определить из выражения
В общем виде формулы для определения RCM можно записать
так: а) если смесь задана объемными долями, то
Пример 1. Воздух по объему состоит из 20,9% кислорода и 79,1% азота. Определить парциальные давления кислорода и азота при давлении смеси 760 мм рт. ст. Состав воздуха взять по массе.
Определим кажущуюся молекулярную массу смеси по уравнению
Состав воздуха
Парциальные давления кислорода и азота
с учетом для каждого компонента![]() получим то же урав-
получим то же урав-
нение, но в другой форме:
б) если смесь задана массовыми долями, то
но так как для любого компонента
то
Формулы для определения парциальных давлений будут иметь
различный вид в зависимости от того, в каких долях задана смесь.
Парциальные давления определяют но следующим формулам:
а) если смесь задана объемными долями, то из уравнений
(34) следует
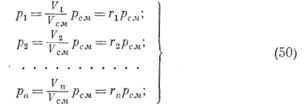
Тогда, используя соотношения (50), получаем
б) если смесь задана массовыми долями, то, принимая во внимание соотношение между объемными и массовыми долями [выражения (42) и (43)], можно записать, что
29
Пример 2. Смесь двух объемов водорода и одного объема кислорода называют гремучим газом. Определить газовую постоянную гремучего газа.
Характеристики
Тип файла документ
Документы такого типа открываются такими программами, как Microsoft Office Word на компьютерах Windows, Apple Pages на компьютерах Mac, Open Office - бесплатная альтернатива на различных платформах, в том числе Linux. Наиболее простым и современным решением будут Google документы, так как открываются онлайн без скачивания прямо в браузере на любой платформе. Существуют российские качественные аналоги, например от Яндекса.
Будьте внимательны на мобильных устройствах, так как там используются упрощённый функционал даже в официальном приложении от Microsoft, поэтому для просмотра скачивайте PDF-версию. А если нужно редактировать файл, то используйте оригинальный файл.
Файлы такого типа обычно разбиты на страницы, а текст может быть форматированным (жирный, курсив, выбор шрифта, таблицы и т.п.), а также в него можно добавлять изображения. Формат идеально подходит для рефератов, докладов и РПЗ курсовых проектов, которые необходимо распечатать. Кстати перед печатью также сохраняйте файл в PDF, так как принтер может начудить со шрифтами.
























