GLAVA7 (1093053)
Текст из файла
68
Таблица 7.1. Изменение термодинамических функций при образовании различных растворов.
| Термодинамические функции | Примеры | |||||||||
|
|
|
| A |
| растворов | |||||
| Идеальный раствор | ||||||||||
|
|
|
| a = N |
| Fe-Ni, Fe-Co, Fe-Mn | |||||
| Регулярный раствор | ||||||||||
|
|
| + RTlnN | а (a = |
| Fe-Si, Fe-Al, Fe-Cu | |||||
| Реальный раствор | ||||||||||
|
| + | + RTlnN - - Т | а (a = |
| Fe-S, Fe-С, Fe-Р | |||||
2. Закон Рауля.
Обширные экспериментальные исследования Франсуа Мари Рауля (1886 г.) обнаружили, что в типичных случаях давление насыщенного пара растворителя над раствором (Р) равно его давлению над чистым растворителем (Р0), умноженному на мольную долю растворителя (N0) в растворе:
Р = Р0 N0. (7.1)
Из (7.1) следует, что Р < Р0, так как N0 < 1. Уменьшение давления насыщенного пара над раствором может быть объяснено уменьшением поверхности испарения при добавлении растворяемого вещества.
Закон Рауля часто применяется в другой, более удобной для практического использования форме. Для этого правая и левая часть (7.1) делится на Р0 и из обоих частей вычитается единица:
где N - молярная доля растворенного вещества.
Из выражения (7.2) следует, что относительное понижение давления насыщенного пара растворителя над раствором, равно молярной доле растворенного вещества.
На практике большинство растворов обнаруживают более или менее значительные отклонения от закона Рауля, растущие с увеличением концентрации.
Растворы, в которых поведение растворенного вещества и растворителя подчиняются закону Рауля называются абсолютно идеальными или совершенными. Для этих растворов закон Рауля справедлив для любых концентраций растворителя и растворенного вещества. Такие растворы образуют вещества с близкими физическими свойствами и, как следствие, при отсутствии взаимодействия частиц растворителя и растворенного вещества.
Например, если компоненты совершенного раствора А, В, то справедливо соотношение:
где РА, РВ - давления насыщенных паров компонентов над раствором;
![]() ,
, ![]() - давления насыщенных паров компонентов над чистыми компонентами;
- давления насыщенных паров компонентов над чистыми компонентами;
NA, NB - мольные доли компонентов.
Из (7.3) следует, что давление паров над раствором (Р) линейно изменяется с изменением состава раствора.
3. Температура замерзания и кипения разбавленных растворов
(следствия из закона Рауля).
Растворы замерзают при более низкой, а закипают при более высокой температуре, чем чистый растворитель. Эти закономерности относятся только к растворам нелетучих веществ в разбавленных растворах, для которых мольная доля растворенного вещества (N) близка к нулю.
Действительно, если давление пара над раствором понижено (Р < P0), то последний нужно нагреть до более высокой температуры, чтобы достигнуть равенства давления пара над раствором и внешнего давления, обеспечивающего кипение (рис. 7.1). Из рис. 7.1 следует, что внешнее давление (РВН) достигается растворителем при температуре ТЕ, а раствором - при Т > TE, так как Р < P0.
Метод исследования, основанный на измерении повышения температуры кипения растворов, называется эбулиоскопическим [ebulliare (лат.) - выкипать], а сам эффект - эбулиоскопическим эффектом.
Условие кипения раствора:
Р = Р0 N0 = РВН, (7.4)
где РВН = 1 (условная единица).
После логарифмирования (7.4) с учетом РВН = 1:
lnР0 + lnN0 = 0,

Из уравнения Клазиуса - Клапейрона следует:
поэтому
где ![]() - молярная теплота испарения растворителя.
- молярная теплота испарения растворителя.
После разделения переменных и интегрирования (7.5):
Рис. 7.1. Повышение температуры кипения раствора:
ТЕ, Т - температура кипения чистого растворителя и раствора соответственно;
РВН - внешнее давление.
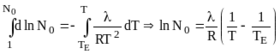
или
Для разбавленных растворов ![]() , а N << N0.
, а N << N0.
Тогда: ![]() , причем точность расчета при этом не хуже 1%, если N < 0,02.
, причем точность расчета при этом не хуже 1%, если N < 0,02.
Таким образом:
Из (7.6) очевидно, что повышение температуры кипения раствора не зависит от природы растворенного вещества, а определяется лишь его молярной долей в растворе.
Выражению (7.6) можно придать иную форму записи, если концентрацию раствора выразить в единицах его моляльности (m):
где ![]() - молярная масса растворителя.
- молярная масса растворителя.
В разбавленном растворе ![]() , поэтому N = m
, поэтому N = m![]() и соотношение (7.6) запишется в виде:
и соотношение (7.6) запишется в виде:
где ![]() = kЭ - эбулиоскопическая постоянная растворителя.
= kЭ - эбулиоскопическая постоянная растворителя.
Тогда:
Эбулиоскопическая постоянная, называемая также молярным повышением температуры кипения, представляет собой величину повышения температуры кипения раствора, содержащего 1 моль растворенного вещества в 1 кг растворителя, по сравнению с температурой кипения чистого растворителя. Каждый растворитель имеет свою эбулиоскопическую постоянную, не зависящую от природы растворенного вещества: kЭ для воды составляет 0,52 К/моль, для бензола 2,57 К/моль.
Эбулиоскопическим методом определяют молярные массы растворенных веществ, однако его используют лишь в тех случаях, когда растворенное вещество нелетучее и растворитель не диссоциирует при температуре кипения раствора.

Совершенно очевидно, что если при замерзании раствора вымораживается чистый растворитель, то условие замерзания раствора имеет вид:
где Р - давление пара растворителя над раство-
ром;
![]() - давление пара растворителя над чис-
- давление пара растворителя над чис-
тым твердым растворителем.
Условие замерзания чистого растворителя:
Согласно уравнению Клаузиуса - Клапейрона (4.80):
Рис. 7.2. Понижение температуры замерзания раствора:
Тf, T - температуры замерзания растворителя и раствора соответственно.
Совместное решение этих уравнений дает:
где ![]() - молярная теплота плавления.
- молярная теплота плавления.
При температуре замерзания раствора ![]() , поэтому
, поэтому  , где
, где ![]() .
.
Тогда окончательно:
Уравнение (7.13) называется уравнением Шредера. Его решение позволяет рассчитать понижение температуры замерзания раствора:
где ![]() - криоскопическая постоянная растворителя, зависящая как и kЭ только от свойств рас-
- криоскопическая постоянная растворителя, зависящая как и kЭ только от свойств рас-
творителя.
Из (7.14) следует, что понижение температуры замерзания разбавленных растворов определяется только концентрацией растворенного вещества.

4. Осмотическое давление растворов.
Явление осмоса (от греч. osmos - толчок, удар) впервые наблюдал А. Нолле, помещая водный раствор сахара в стеклянной, закрытой снизу полупроницаемой перепонкой трубке в сосуд с чистой водой. Вода, проникая через перепонку, вызывала подъем уровня раствора в трубке (рис. 7.3).
Для предотвращения проникновения растворителя в раствор над раствором нужно создать избыточное давление (Р’), называемое осмотическим.
Рис. 7.3. Схема опыта А. Нолле:
1 - трубка с раствором сахара;
2 - сосуд с водой;
3 - полупроницаемая перепонка.
Проявления осмотического давления весьма разносторонние. Например, типичные клетки живых организмов, образованные протоплазменной оболочкой, заполненной водным раствором различных веществ, испытывает осмотическое давление со стороны чистой воды в пределах от 4 до 20Характеристики
Тип файла документ
Документы такого типа открываются такими программами, как Microsoft Office Word на компьютерах Windows, Apple Pages на компьютерах Mac, Open Office - бесплатная альтернатива на различных платформах, в том числе Linux. Наиболее простым и современным решением будут Google документы, так как открываются онлайн без скачивания прямо в браузере на любой платформе. Существуют российские качественные аналоги, например от Яндекса.
Будьте внимательны на мобильных устройствах, так как там используются упрощённый функционал даже в официальном приложении от Microsoft, поэтому для просмотра скачивайте PDF-версию. А если нужно редактировать файл, то используйте оригинальный файл.
Файлы такого типа обычно разбиты на страницы, а текст может быть форматированным (жирный, курсив, выбор шрифта, таблицы и т.п.), а также в него можно добавлять изображения. Формат идеально подходит для рефератов, докладов и РПЗ курсовых проектов, которые необходимо распечатать. Кстати перед печатью также сохраняйте файл в PDF, так как принтер может начудить со шрифтами.




















