Первопричины коррозии
2.1. Первопричины коррозии
Можно было бы начать с предположения, что основная причина электрохимической коррозии - гальваническая неоднородность c образованием на поверхности металлического сооружения множества микроанодов, например, за счет структурной неоднородности сплавов из-за наличия в них легирующих добавок и примесей. Но почему же тогда корродируют, как подтверждает опыт, электрохимически абсолютно однородные, чистые металлы?
Теоретики коррозии разделились на приверженцев теории микрогальванических элементов и теории гомогенного растворения. Последние могут обойтись без понятия “гальваническая гетерогенность”, хотя и не отрицают ее. Действительно, как бы ни была отполирована поверхность химически чистого металлического тела, на молекуляром уровне вы встретите такой набор неожиданностей и неоднородностей, что ни о какой гомогенности и эквипотенциальности двух соседних точек и речи не может быть. Так, две разные грани одного кристалла металлического тела имеют разные электрохимические потенциалы. Это и есть первая гальваническая пара на микроуровне.
Как вы увидете ниже, обе эти теории не антогонистичны. Поэтому забудем на время о гальванических парах, возникающих по каким-то причинам на металлической поверхности.
Пусть будет только вода и кислород.
Одна из удивительных особенностей молекулы воды - ее дипольные свойства. Несмотря на уравновешенность зарядов Н+ и OH- внутри молекулы, вода - полярно заряженная частица, способная притягиваться к положительно или отрицательно заряженным ионам окружающей среды, например, к ионам железа (рис.2.1).
Атомы металла образуют кристаллическую решетку, в пространстве которой свободно перемещаются электроны, покинувшие свои атомы, - так называемые, валентные электроны, что и показано на рис.2.1, как первое событие процесса коррозии.
Неуравновешенный ионизированный атом металла Fe+ - до тех пор пока он лишен электрона - является слабым местом решетки. Если этот ион доступен для атаки молекул воды, например, он находится на самой поверхности металла, а лучше - на вершине гребня или неровности поверхности, то вступают в действие электростатические силы притяжения. Окружая ион металла, молекулы воды - в силу своей подвижности - способны расшатать решетку и отделить ион.
Не будь противодействия такому началу, кристаллическая решетка быстро бы разрушилась. Противодействие процессу “ растаскивания” организует фронт валентных электронов - облако свободно странствующих отрицательно заряженных частиц. Электроны, лишенные материнских сил поддержки со стороны своих атомов, ушедших в раствор, собираются вблизи границы металл-электролит, пытаясь вернуться к брошенным ими ранее частицам металла. Начинается перетягивание кто-кого: электроны - в одну сторону, вода - в другую. Если процесс возврата ионов металла идет с такой же скоростью, что и процесс их ухода “в воду”, то на границе устанавливается динамическое равновесие без каких либо материальных потерь. Возникает так называемый ток обмена и формируется двойной электрический слой: его внешней обкладкой являются гидратированные ионы металла, внутренней - электроны.
Однако равновесие может быть нарушено, если вмешается третья сила, способная благоприятствовать тому или противоположному фронту на двойном слое. Такая сила исходит от молекулы кислорода, которая подобно молекуле воды, являясь в целом нейтральной, но способна, что весьма удивительно при ее электронейтральности, притягивать к себе электроны. В данной ситуации агрессоры поделили сферу деятельности: воде - положительно заряженная частица металла, кислороду - отрицательная.
Бесплатная лекция: "Часть 47" также доступна.
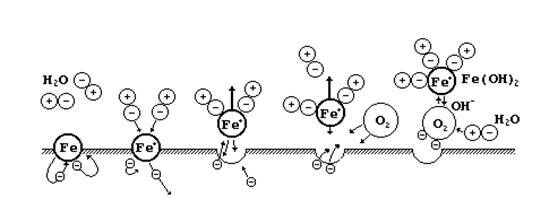
Рис.2.1. Этапы развития коррозионного процесса под действием воды и кислорода
Кислород ассимилирует электрон и образует вне пределов металла некоторую отрицательно заряженную частицу.
Связывая электрон, кислород, таким образом, облегчает работу молекулам воды, которые теперь уже безпрепятственно отрывают, нейтрализуют и безвозвратно уносят ион металла. Разрушение - свершившийся факт.
Таким образом, для безостановочного протекания процесса разрушения достаточно воды и кислорода.
Заметьте, объяснить первопричину коррозии, как вы видете, можно и без привлечения понятия гальванической пары. Но дальше это делать уже трудно и даже нецелесообразно.





















