Определение числа единиц переноса
Определение числа единиц переноса ( )
)
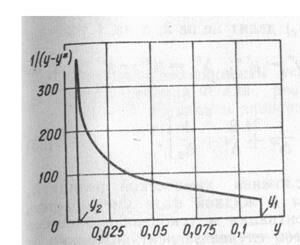
1. Метод графического интегрирования – заключается в том, что на диаграмме, построенной в координатах  находят площадь, ограниченную кривой, осью абцисс (х) и вертикальными прямыми, проведенными через точки на оси абцисс
находят площадь, ограниченную кривой, осью абцисс (х) и вертикальными прямыми, проведенными через точки на оси абцисс  и
и  , являющимися пределами интегрирования. Эта площадь с учетом масштабов по осям x и y, равна числу единиц переноса:
, являющимися пределами интегрирования. Эта площадь с учетом масштабов по осям x и y, равна числу единиц переноса:
 ;
;
где:  - число единиц “
- число единиц “ ” в 1 см по оси абцисс;
” в 1 см по оси абцисс;
 - число единиц “
- число единиц “ ” в 1 см по оси ординат.
” в 1 см по оси ординат.
 |
Тогда из уравнения


 .
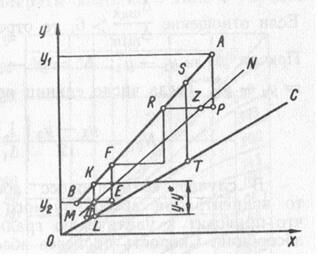
. 2. Графический метод – рабочая линия – прямая, равновесная зависимость нелинейна. Для определения  строят диаграмму y – x, на которую наносят рабочую линию AB (прямая
строят диаграмму y – x, на которую наносят рабочую линию AB (прямая  ) и линию равновесия OC (прямая
) и линию равновесия OC (прямая  ), затем проводят среднюю линию MN, проходящую через точки, делящие пополам отрезки ординат между рабочей линией и линией равновесия. Затем из точки В, характеризующей конечное состояние газа, проводят линию BD до пересечения со средней линией и продолжают ее до точки Е, при этом отрезок BD=DE. Затем из точки Е восстанавливают перпендикуляр EF до пересечения с рабочей линией и ставят точку F, причем EF=2KD=KL. Отрезок EF показывает изменение концентрации газа, равной одной единице переноса (ступенька BEF). Продолжая аналогичное построение ступенек до начального состояния газа (точка А), определяем
), затем проводят среднюю линию MN, проходящую через точки, делящие пополам отрезки ординат между рабочей линией и линией равновесия. Затем из точки В, характеризующей конечное состояние газа, проводят линию BD до пересечения со средней линией и продолжают ее до точки Е, при этом отрезок BD=DE. Затем из точки Е восстанавливают перпендикуляр EF до пересечения с рабочей линией и ставят точку F, причем EF=2KD=KL. Отрезок EF показывает изменение концентрации газа, равной одной единице переноса (ступенька BEF). Продолжая аналогичное построение ступенек до начального состояния газа (точка А), определяем  , если в конце получается неполная ступенька, то ее принимаем за полную:
, если в конце получается неполная ступенька, то ее принимаем за полную:  .
.
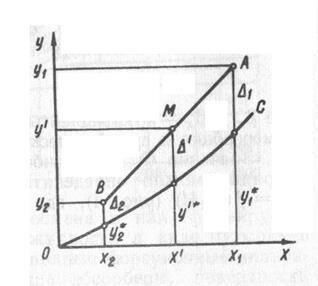
3. Метод численного интегрирования – рабочая линия нелинейна, равновесная зависимость линейна. Суть метода заключается в том, что на диаграмме y – x отрезок  делят на два равных участка. Вертикальные отрезки между рабочей линией AB и линией равновесия OC, проведенные из точек состояния газа в начале и в конце процесса (точка А, точка В), а также средней точки М, показывают значения движущей силы прцесса:
делят на два равных участка. Вертикальные отрезки между рабочей линией AB и линией равновесия OC, проведенные из точек состояния газа в начале и в конце процесса (точка А, точка В), а также средней точки М, показывают значения движущей силы прцесса:
Рекомендуемые материалы
 ;
;  ;
;  ;
;  ;
;
 ;
;
 ;
;
Если отношение  , то отрезок делят не на 2, а на 4 участка, причем:
, то отрезок делят не на 2, а на 4 участка, причем:
 ;
;  ;
;  ;
;  ;
;  ;
;
 .
.
Технология расчета абсорбционных процессов при физической абсорбции заключается в следующем:
1. решение уравнения материального баланса и определение расхода абсорбера;
2. выбор типа и конструкционных размеров контактного устройства (тарелки и насадки);
3. выбор рабочей скорости газа и расчет диаметра абсорбера
4. расчет необходимой поверхности контакта фаз, коэффициента массоотдачи и массопередачи и определение высоты насадки или числа тарелок;
5. определение высоты абсорбера и расчет его гидравлического сопротивления.
Пример 1
Объемная концентрация NH3 в воздухе  =0,12 кг/м3 , T=300K, P=
=0,12 кг/м3 , T=300K, P= кПа
кПа
Мольная масса NH3 – (Mk =17), мольная масса носителя (инертного газа - воздуха) Мог =29
Решение:
 кг/кмоль.
кг/кмоль.
Тогда: объемная концентрация  кмоль/м3
кмоль/м3
мольная:  кмоль/кмоль
кмоль/кмоль
массовая:  кг/кг
кг/кг
Парциальное давление компонента:  кПа
кПа
Относительная концентрация:  .
.
Пример 2
Концентрация поташа (K2CO3) после поглощения его водой:
 =200 кг/м3, Мк=138 кг/кмоль,
=200 кг/м3, Мк=138 кг/кмоль,
Концентрация H2S:
 =15 кг/м3,
=15 кг/м3,  =34 кг/кмоль,
=34 кг/кмоль,  =1200 кг/м3
=1200 кг/м3
Растворитель – вода, Мж=18 кг/кмоль
Выразить состав раствора в мольных долях
Решение:

 мольных доль;
мольных доль;
 м.д.
м.д.
Пример 3
Определить количество поглощаемого NH3 , расход поглотителя (L) и движущую силу процесса при абсорбции аммиака водой из смеси его с воздухом G0=13600 м3/ч, ( =0,1 мПа, t0=0
=0,1 мПа, t0=0  ),
),  - 5%,
- 5%,  =0,27
=0,27
Содержание аммиака в жидкости  =0,0020 кмоль NH3/кмоль H2O;
=0,0020 кмоль NH3/кмоль H2O;
 =200С ,
=200С ,  =200С. Давление газа в абсорбере P0=
=200С. Давление газа в абсорбере P0= Па.
Па.
Рещение:
Расчет материального баланса: т.к. содержание аммиака в исходно смеси не превышает 10% то выражение концентраций приведем в относительных концентрациях
G=G0(1-0,05)=13600(1-0,05)=12920 м3/ч – расход воздуха
или 12920/22,4=576,8 кмоль/ч
Относительный мольный состав газовой фазы:
Y1=5/(100-5)=0,0526 кмоль NH3/кмоль возд. – в начале;
Y2=0,27/(100-0,27)=0,0027 кмоль NH3/кмоль возд. – в конце.
Количество NH3 , поступающего на абсорбцию:
Mнач= =
= =30,34 кмоль/ч;
=30,34 кмоль/ч;
Mк=  =
= =1,56 кмоль/ч;
=1,56 кмоль/ч;
М= Mнач-Mк=30,34-1,56=28,78 кмоль/ч.
Пример 4
Требуется поглотить чистой водой 1 т. SO2 в час из газов, содержащих 5% - SO2, 95% - N2.
Qж взято на 20% больше Qж мин необходимого,
 =90%, Pат=760 мм.рт.ст., tж=200С,
=90%, Pат=760 мм.рт.ст., tж=200С,
Растворимость SO2 в воде при t=200с
| Концентрация SO2, % | 1 | 0,7 | 0,5 | 0,3 | 0,2 | 0,15 | 0,1 | 0,05 | 0,02 |
| Парциальное давление SO2 над раствором, мм.рт.ст. | 59 | 39 | 26 | 14,1 | 8,4 | 5,8 | 3,2 | 1,2 | 0,5 |
Определить  .
.
Решение:
Парциальное давление компонента газовой смеси
Pi= мм.рт.ст.
мм.рт.ст.
Такому давлению соответствует концентрация в растворе 0,69%, т.е. в 100кг воды – 69кг SO2
Общее количество поглощаемого SO2 по заданию – 1000кг
Поэтому минимальное количество орошающей жидкости:
Qж мин = =
= =145000 кг/ч=145м3/ч;
=145000 кг/ч=145м3/ч;
Действительное количество жидкости:
Qж= =174 м3/ч
=174 м3/ч
Из уравнения материального баланса  .
.
Давление на выходе из аппарата Pвых= =3,95 мм.рт.ст..
=3,95 мм.рт.ст..
Содержание SO2 в абсорбенте, выходящем из аппарата
 = Qж, т.е.
= Qж, т.е.  =
= =0,575 кг на 100кг
=0,575 кг на 100кг
Такому содержанию SO2 соответствует парциальное давление 30,87 мм.рт.ст.
 =38-30,87=7,13 мм.рт.ст.
=38-30,87=7,13 мм.рт.ст.
 =(7,13+3,95)/2=5,54 мм.рт.ст.=730 Па
=(7,13+3,95)/2=5,54 мм.рт.ст.=730 Па
Пример 5
Рассчитать количество поглощенного СO2, расход поглотителя и движущую силу процесса
При абсорбции СO2 водой из газовой смеси состава:
СO2 – 30,2%, CO – 4%, H2 – 48%, N2 – 17,8%.
Расход газа: V=10000м3/ч (при н.у.)
G1=452,5 кмоль/ч
Давление 1,6 мПа
Орошение водой (Xн=0) t=250с
Степень извлечения СO2:  =95%
=95%
Решение:
Т.к. содержание СO2>10%, то выражение концентрации выбираем в мольных долях (если бы  , то в относительных концентрациях).
, то в относительных концентрациях).
По уравнению W=
Мольная доля СO2 на входе в аппарат:
 =0,302,
=0,302,
а количество СO2:
M1=  =136,65 кмоль/час.
=136,65 кмоль/час.
Количество поглощенного СO2
W=  =129,82 кмоль/час.
=129,82 кмоль/час.
Количество газа, выходящего из аппарата:
G2= G1-W=452,5-129,82=322,66 кмоль/час
Количество СO2 в выходящем газе:
M2= M1-W=136,65-129,82=6,83 кмоль/час.
Мольная доля СO2 в уходящем газе:
 = M2/ G2=6,83/322,66=0,021 (2,1%).
= M2/ G2=6,83/322,66=0,021 (2,1%).
Построение рабочей характеристики процесса по закону Генри:
Закон Генри:  .
.
 ;
;
где:  ,
,  - коэффициенты при
- коэффициенты при  ,
,  ,
,  ;
;
 - парциальное давление
- парциальное давление  в газе.
в газе.
 МПа.
МПа.
Закон Дальтона:  МПа.
МПа.
Из закона Генри:  ;
;
из уравнения 

 ;
;
где:  - равновесная концентрация в газе;
- равновесная концентрация в газе;
 - равновесная линия процесса.
- равновесная линия процесса.
 |
y
В С
D
А
x 103
Определение расхода абсорбента:
 кмоль/ч;
кмоль/ч;
увеличенный в 1,3 раза:  кмоль/ч,
кмоль/ч,
тогда:  ,
,
а содержание  в выходящей воде:
в выходящей воде:
 - равновесная концентрация
- равновесная концентрация  в газе.
в газе.
Тогда:  .
.
Построение рабочей линии процесса: уравнение рабочей линии имеет вид кривой:
 ;
;
Бесплатная лекция: "24 Промежуточный и итоговый контроль" также доступна.
где:  - удельный расход поглотителя:
- удельный расход поглотителя:  .
.
Применим метод Симпсона – заменим кривую линию АВ ломаной АЕВ.
Для точки Е:  .
.
Определим значение  из уравнения:
из уравнения:


 ;
;
 .
.





















