Фазы в легированных сталях
2 фазы в легированных сталях
Как правило, в специальных сталях и сплавах легирующие элементы, входящие в их состав, не являются самостоятельными компонентами, а образуют фазы. Такими фазами могут быть твердые растворы и промежуточные фазы (карбиды, нитриды, интерметаллиды и т.п.) Структура и свойства сталей определяются составом и строением фаз, их распределением в структуре и взаимодействием между собой. Рассмотрим особенности фаз в легированных сталях.
2.1 Твердые растворы на основе железа
В сталях и сплавах возможны три случая растворимости.
Компоненты практически не растворяются. При этом образуется гетерогенная смесь элементов (например, свинецсодержащие стали повышенной обрабатываемости). Полной нерастворимости компонентов фактически нет. Так, в свинецсодержащих сталях максимальная растворимость свинца в у-железе при 1450 °С составляет 0,02 %, а в α-железе при 850 °С 0,001 %. Практически не растворяются в α-железе сера, цирконий, гафний, тантал, висмут. Системы, в которых максимальная растворимость элемента в железе менее 0,2 %, будем классифицировать как твердые растворы с незначительной растворимостью.
Компоненты имеют неограниченную полную растворимость. В этом случае атомы разных элементов образуют общую кристаллическую решетку - непрерывный твердый раствор. Железо с легирующими элементами образует непрерывные твердые растворы в системах Fe-Cr; Fe-V (α-твердые растворы) и Fe-Mn; Fe-Ni; Fe-Co (γ-твердые растворы). Однако и в некоторых из этих сплавов при определенных концентрациях легирующего элемента и температурах образуются промежуточные фазы - интерметаллиды.
Компоненты ограниченно растворимы, т.е. на диаграмме состояния со стороны «чистого» элемента образуется ограниченный твердый раствор, имеющий кристаллическую решетку растворителя. Величина растворимости будет различной в каждой системе, т.е. ограниченные твердые растворы будут иметь неодинаковую область гомогенности (концентрационные границы существования твердого раствора).
В большинстве систем на основе железа образуются именно ограниченные твердые растворы. В зависимости от величины области гомогенности будем классифицировать такие растворы, как ограниченные с широкой областью гомогенности (в железе растворяется более 2 % элемента) и с узкой областью гомогенности (от 0,2 до 2 %).
Таким образом, по растворимости легирующих элементов в железе твердые растворы подразделяются на непрерывные, ограниченные с широкой областью гомогенности, ограниченные с узкой областью гомогенности, с незначительной растворимостью.
Рекомендуемые материалы
Растворение легирующих элементов в железе может происходить по типу замещения и внедрения.
Закономерности образования твердых растворов замещения
Твердые растворы замещения на основе железа образуются в соответствии с общими законами образования твердых растворов такого типа (условия Юм-Розери).
Условиями, определяющими растворимость компонентов в растворах замещения, являются: изоморфизм, т.е. однотипность решеток компонентов, составляющих раствор; соотношение атомных размеров компонентов («размерный фактор»); электронная структура компонентов, т.е. относительное расположение компонентов в периодической системе элементов Д.И. Менделеева.
Неограниченные твердые растворы с железом образуют Ni, Co, Мп, Сг и V. Причем Ni, Co и Мп образуют непрерывные твердые растворы на основе γ-железа, а Сг и V на основе α-железа. Здесь соблюдается первое условие Юм-Розери - изоморфность решеток растворителя и растворенного вещества. При разных типах решеток компонентов неограниченный твердый раствор образован быть не может. Это условие является необходимым, но недостаточным для образования неограниченных твердых растворов, а именно: далеко не всегда изоморфность решеток приведет к созданию таких твердых растворов. Это хорошо видно на примере систем α-железо -Мо, α-железо - W (о.ц.к. решетки), а также γ-железо - Сu, γ-железо - А1 (г.ц.к. решетки). В этих системах образуются ограниченные твердые растворы, несмотря на однотипность решеток железа и легирующего элемента.
Вторым необходимым условием образования твердых растворов является соблюдение «размерного фактора». При образовании неограниченных и ограниченных твердых растворов атомные радиусы растворителя и растворенного элемента должны различаться не более чем на ±15 %.
Как показано И.И. Корниловым, неограниченные твердые растворы на основе железа и других тугоплавких металлов образуются, если это различие не более ±8 %.
Атомные размеры никеля, кобальта, марганца, хрома и ванадия отличаются от атомных размеров изоморфных с ними модификаций железа не более чем на 8 %, эти элементы с железом образуют неограниченные твердые растворы. Ограниченные твердые растворы с широкой областью гомогенности образуют эти же элементы с неизоморфными модификациями железа. Молибден и вольфрам, которые имеют размерный фактор за пределами 8 % (соответственно 10 и 11 %), образуют с обеими модификациями железа ограниченные растворы с широкой областью гомогенности. Элементы с атомным радиусом на пределе размерного фактора (титан, ниобий, тантал) образуют лишь ограниченные растворы с узкой областью гомогенности или практически нерастворимы в железе. Когда размерный фактор выходит за пределы 15 % (цирконий, гафний, свинец), элементы имеют незначительную растворимость в железе.
Однако размерный фактор является необходимым, но недостаточным условием, определяющим образование твердого раствора замещения.
Значения предельной растворимости легирующих элементов в железе зависят от взаимного расположения этих элементов в периодической системе. Наибольшую растворимость в железе имеют элементы, находящиеся в том же периоде, что и железо, а также расположенные в наиболее близких к нему V...VIII группах. Как известно, по мере удаления от железа увеличивается различие в строении внешних d- и s-электронных оболочек d-переходных металлов, изменяется металлическая валентность и электрохимические свойства элементов, т.е. обычно говорят, что изменяется сродство к электрону. В свою очередь электронное строение определяет и атомные размеры элементов. Поэтому как размерный фактор, так и сродство к электрону являются связанными между собой параметрами, определяющими растворимость элементов в железе.
Роль электронного строения компонентов при образовании твердых растворов на основе железа установлена далеко не однозначно, во всяком случае, электронная теория ограниченных твердых растворов в сплавах железа еще далека от подобной теории для твердых растворов на основе благородных металлов (электронные соединения на основе меди, серебра и золота). Роль сродства к электрону для твердых растворов в сплавах железа освещена в трудах В.К. Григоровича.
Необходимо также отметить, что все рассмотренные выше закономерности образования твердых растворов на базе железа установлены для двойных систем железо-легирующий элемент. В реальных сталях и сплавах образуются многокомпонентные твердые растворы. Закономерности образования твердых растворов для конкретных многокомпонентных систем будут рассмотрены при изложении материалов по соответствующим легированным сталям.
Закономерности образования твердых растворов внедрения
Твердые растворы внедрения образуют элементы внедрения с малыми атомными размерами. Значения атомных радиусов rх элементов внедрения приведены ниже:
Элемент внедрения В С N О Н
rx, нм................. 0,091 0,077 0,071 0,063 0,046
Твердые растворы внедрения всегда ограничены, а растворимость в них зависит от кристаллической структуры металла-растворителя и размеров атома элемента внедрения. Ограниченность твердых растворов внедрения определяется тем, что они сохраняют решетку металла-растворителя, а атомы внедрения в них занимают лишь вакантные междоузлия - октаэдрические и тетраэдрические поры в решетке металла-растворителя. Часть пор всегда не заполнена. Cхема расположения пор в α-и γ-железе приведена на рисунке 6.
Наиболее благоприятными позициями расположения атомов внедрения в твердом растворе будут октаэдрические поры в α-железе и окта- и тетраэдрические поры в γ-железе. Междоузлие обязательно должно быть меньше, чем размер атома внедрения, так как в противном случае прочной связи между атомами металла-растворителя и атомами внедрения не будет. Однако размер поры не должен быть и слишком малым, так как внедрение атома вызовет ослабление связей между атомами решетки растворителя, и структура такого твердого раствора будет неустойчивой. Какая из пор является наиболее благоприятной для размещения в ней атома внедрения, будет определяться не только ее размерами, но и количеством соседних атомов, претерпевших деформацию при образовании твердого раствора внедрения. Так, в α-железе растворение углерода и азота происходит в октаэдри-ческих порах, меньших по размеру, чем тетраэдрические, так как в первом случае смещаются два атома вдоль ребра куба в направлении с малой плотностью упаковки, а во втором - четыре атома в направлении плотной упаковки. Таким образом, энергия деформации о.ц.к. решетки от внедрения атомов углерода или азота в окта-пору будет меньше, чем при внедрении их в тетра-пору.
Растворимость атомов внедрения увеличивается с уменьшением размера атомов, т.е. возрастает в ряду B-C-N-O-H. Из перечисленных атомов внедрения наибольшее значение при рассмотрении легированных сталей имеют углерод и азот. Данные по их растворимости в α-железе приведены на рис. 7. Как видно, азот, имеющий меньший атомный радиус (0,071 нм), чем углерод (0,077 нм), растворяется в α-железе в значительно большем количестве. В γ-железе максимальная растворимость азота также больше, чем углерода (2,8 и 2,0 % соответственно). Значительно большая растворимость углерода и азота в γ-железе по сравнению с α-железом связана с тем, что в г.ц.к. решетке размер пор больше, а их число меньше, чем в о.ц.к. решетке, т.е. для α-железа характерна большая рыхлость упаковки.
Необходимо также отметить, что значительная деформация решетки при внедрении атомов неметалла в пору решетки металла-растворителя приводит к тому, что значительное число пор не заполняется атомами внедрения. Так, при предельном насыщении углеродом γ-железа (до 2 % С) один атом углерода приходится на каждые три элементарных ячейки γ-железа [-8 % (ат.) С], а для α-железа (0,018 % С) один атом углерода на 600 элементарных ячеек [0,083 % (ат.) С]. Столь значительное различие растворимости углерода в двух модификациях железа обусловливает возможность различной термической обработки сталей.
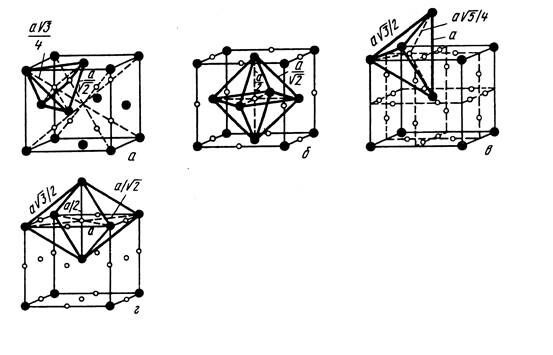
Рис.6 – Положение октаэдрических (б, г) и тетраэдрических пор в г.ц.к. (а, б) и о.ц.к. (а, г) решетках.
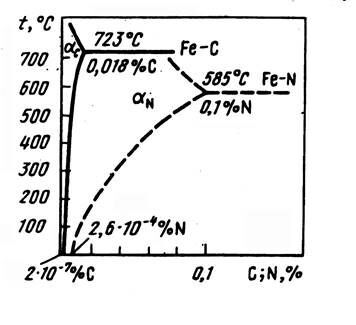
Рис.7 – Температурная зависимость растворимости углерода (сплошные линии) и азота (штриховые линии) в α-железа.
Твердые растворы внедрения образуются при выполнении условия (правила Хэгга)
rx / rMe < 0,59
где rх - радиус атома внедрения (неметалла); rMe - радиус атома-растворителя (металла).
На основании роли размерного фактора для твердых растворов внедрения (rx / rMe, <0,59) и замещения (rx / rMe = 0,85-1,15) следует сказать, что отношение атомных размеров в пределах 0,59-0,85 является неблагоприятным для образования твердых растворов. В этом случае, как будет показано ниже, получаются химические соединения со сложной структурой.
2.2. Влияние легирующих элементов на свойства феррита
Феррит – одна из основных фаз во многих сталях. В конструкционных сталях его доля составляет 95 %, поэтому значение свойств легированного феррита позволит правильно оценить общий уровень свойств сталей.
Легированный феррит представляет собой многокомпонентный твердый раствор по типу замещения и внедрения легирующих элементов и примесей в a-железе. Дислокационные теории упрочнения твердых растворов при легировании не дают для сплавов железа совпадения расчетов с экспериментом.
Эмпирически установлено, что количественная оценка упрочнения железа при легировании возможна на основе аддитивного вклада упрочняющего влияния отдельных легирующих элементов на свойства a-твердого раствора железа. Так, при одновременном легировании a-феррита атомами нескольких легирующих элементов их влияние на упрочнение может быть просуммировано.
Необходимо отметить, что при оценке упрочнения феррита по приведенной формуле следует брать концентрацию легирующего элемента, растворенного в феррите, а не содержание этого элемента в стали.
На рис. 8 представлено влияние концентраций элементов замещения на свойства железа высокой чистоты. Эти данные показывают, что в области малых концентраций наибольшее упрочняющее влияние оказывает фосфор, тогда как хром, находящийся в феррите, в наименьшей степени упрочняет железо. Прочность феррита сильно зависит от диаметра зерна (рис.9).

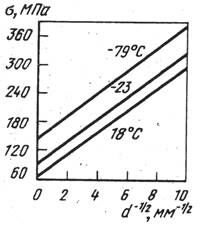
| Рис 8. Зависимость предела текучести железа от содержания легирующих элементов замещения | Рис. 9. Зависимость предела текучести железа от размера зерна |
Значение sт, феррита будет зависеть от твердорастворного упрочнения, плотности дислокации, наличия дисперсных частиц, а Ку от наличия примесей внедрения в твердом растворе, блокировки дислокации примесями, угла разориентировки границ. Для низкоуглеродистых сталей, феррита технической чистоты значения Ку составляет 0,57-0,73, а для железа высокой чистоты 0,16-0,19 МПа/м.
Таким образом, чем меньше размер зерна, тем выше должна быть прочность феррита. Эффективность зернограничного упрочнения определяется степенью измельчения зерна.
Важнейшей характеристикой стали является значение порога хладноломкости Тхл или температуры перехода Тпр из вязкого в хрупкое состояние, характеризующее склонность стали к хрупкому разрушению.
Измельчение зерна положительно сказывается не только на склонности к хрупким разрушениям, но оно одновременно приводит к упрочнению.
Многочисленные исследования легированного феррита показывают, что собственно упрочнение феррита при легировании отрицательно сказывается на склонности его к хрупким разрушениям. Однако влияние легирующих элементов на температуру перехода индивидуально.
На рис. 10 приведены данные по влиянию марганца, кремния, хрома, ванадия и никеля на порог хладноломкости железа Т50. В области малых концентраций легирующих элементов замещения температура перехода несколько снижается, а при большем их содержании заметно повышается. Никель в отличие от других легирующих элементов при всех концентрациях существенно понижает порог хладноломкости. Концентрация легирующих элементов, до которой понижается порог хладноломкости феррита для ванадия и хрома, составляет <1 %, для кремния <0,8 %, для марганца <2%; в реальных сталях эти значения будут другими.
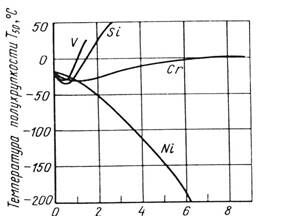
Легирующий элемент, %
Рис. 10. Влияние легирующих элементов на температуру перехода Т50 железа
2.3. Влияние легирующих элементов на свойства аустенита
В железоуглеродистых сталях аустенит, как стабильная структурная составляющая, существует лишь при температурах выше Ас3. В специальных легированных сталях благодаря влиянию легирующих элементов на расширение g-области, увеличению устойчивости переохлажденного аустенита и понижению мартенситной точки аустенит может быть одной из главных структурных составляющих сталей в состоянии их эксплуатации. Поэтому знание свойств легированного аустенита наиболее важно для таких высоколегированных сталей, как нержавеющие, жаропрочные, немагнитные и др.
Изменение свойств аустенитных сплавов при легировании может быть обусловлено как влиянием легирующих элементов на свойства собственно твердого раствора - аустенита, так и их влиянием на стабилизацию аустенита к фазовым переходам, т.е. легирование может вызывать превращение аустенита с образованием других фаз (например, a - и e - фаз в сплавах Fe-Mn и a -фазы в сплавах Fe-Ni). Легированный аустенит подразделяют на стабильный и нестабильный, При температуре выше начала мартенситного превращения Мн нестабильный аустенит способен к фазовому превращению - образованию мартенсита в результате приложения внешней нагрузки (деформации), т.е. деформация нестабильного аустенита вызывает мартенситное превращение, так же как и охлаждение его ниже Мн. Стабильный аустенит не претерпевает фазового превращения под влиянием деформации, при этом изменяется лишь его структура. В зависимости от того, какие легирующие элементы, входя в состав аустенита и каково их количество, изменяется устойчивость аустенита к распаду при деформации, т.е. степень его нестабильности.
В этом разделе рассмотрено влияние легирования на свойства собственно аустенита, т.е. легирование стабильного аустенита.
Изменение свойств собственно аустенита при легировании в общих чертах описывается теориями упрочнения твердых растворов. Так, упрочнение, определяемое параметром несоответствия по размерам, хорошо иллюстрируется рис.11, на котором представлена зависимость изменения твердости ∆HV от параметра решетки ∆а хромоникелевого аустенита при введении в него 1 % легирующих элементов замещения и внедрения. Упрочнение тем больше, чем больше это несоответствие. Однако для элементов внедрения (С, М) и замещения (Мn, V, Со, Мо, W, А1, Сг, Ni, Si) эффективность упрочнения при одинаковых значениях а различна. Наибольший вклад в упрочнение аустенита вносят элементы внедрения, особенно азот. В отличие от a-железа растворимость азота в легированном аустените значительно выше и может превышать 1 % при комнатной температуре.
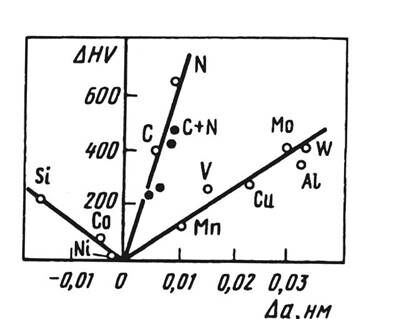
Рис.11- Зависимость упрочнения аустенита (DНV) от изменения параметра решетки (Dа) при легировании хромоникелевого аустенита 1% (ат.) различных элементов
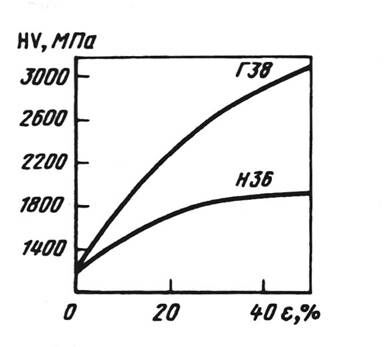
Рис.12 - Зависимость твердости HV марганцевого (Г38) и никелевого (Н36) аустенита от степени пластической деформации e
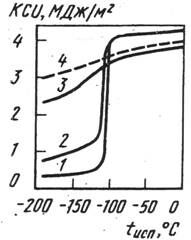
Рис. 13 - Зависимость ударной вязкости от температуры испытания марганцевого (1-3) и никелевого (4) аустенита
1-сплав Г40; 2-Г40Н10; 3-Г40Х10; 4-Н36
Эффективность влияния легирующих элементов на свойства аустенита определяется базовыми аустенитными; композициями, на которых основан данный аустенит. Такими основными композициями являются Fе-Ni; Fе-Мn; Fе-Сг-Ni; Fе-Сг-Мn; Fе-Сг-Ni-Мn. Главными аустенитообразователями во всех перечисленных аустенитных композициях являются никель и марганец, а аустенит, полученный на их основе, называют соответственно никелевым и марганцовистым. Свойства их существенно различаются.
Существенная разница в свойствах марганцевого и никелевого аустенита объясняется различными значениями энергии дефектов упаковки (ЭДУ) в этих сплавах. В марганцевом аустените значение энергии дефектов упаковки заметно меньше, чем в никелевом аустените. Как известно, энергия дефектов упаковки - одна из важнейших характеристик дислокационной структуры, определяющей свойства аустенита. Так, подвижность дислокации (способность их к поперечному скольжению, легкость пересечений) зависит от энергии дефекта упаковки. При этом в сплавах с ГЦК решеткой этот фактор играет в упрочнении большую роль, чем взаимодействие дислокации с атомами внедрения и замещения и силы трения решетки.
Показателем энергии дефектов упаковки является вероятность их образования, а чем больше вероятность образования дефектов упаковки в сплаве, тем меньше энергия дефектов упаковки. В марганцовистом аустените значения энергии дефектов упаковки ниже, а вероятность их образования выше, чем в никелевом аустените (рис.14).
А это однозначно указывает на пониженную подвижность дислокации, и, следовательно, более интенсивное деформационное упрочнение марганцовистого аустенита.
Необходимо отметить, что, изменяя содержание никеля и марганца в аустенитных сплавах на базе других композиций, можно существенно менять энергию дефектов упаковки в аустените, т.е. изменять способность аустенита к упрочнению при пластической деформации. При этом легирование аустенита марганцем будет приводить к увеличению коэффициента деформационного упрочнения аустенитных сталей, а легирование никелем, наоборот, уменьшать такое упрочнение. В чем причина такого влияния марганца на энергию упаковки аустенита, т. е. на его повышенную способность к деформационному упрочнению?
Рис. 14 - Зависимость вероятности образования (а) и энергии дефектов упаковки (ДУ) марганцевого (Г38) и никелевого (Н36) аустенита от температуры деформации
Как установлено В.С. Литвиновым при исследовании межатомного взаимодействия в сплавах методом ядерной гамма-спектроскопии (эффект Мессбауэра), основная роль марганца заключается в изменении взаимодействия атомов железа между собой. Под влиянием марганца происходит перераспределение внешних электронов от атомов железа к атомам марганца, в результате чего d-электроны атомов железа принимают большее участие в связи. Изменение характера пространственного распределения электронов является основным фактором в определении свойств железомарганцевых сплавов. Низкие значения энергии дефектов упаковки, большая вероятность их образования и высокое упрочнение марганцевого аустенита - результат проявления характера межатомного взаимодействия в таких сплавах. Противоположный характер перераспределения электронов между атомами компонентов в сплавах Fе-Мn и Fе-Ni обусловливает различие в свойствах аустенита и мартенсита этих сплавов.
Причиной хладноломкости железомарганцевого аустенита является фазовый переход I рода - при этих температурах гранецентрированная кубическая решетка (ГЦК) переходит в гранецентрированную тетрагональную решетку (ГЦТ). Пока сохраняется кубическая фаза, аустенит хладостоек; при появлении тетрагональных искажений у плотноупакованной структуры он становится хладноломким. Такие искажения в решетке обусловлены локализацией связи при понижении температуры. Следовательно, последнее является основной причиной хрупкости при низких температурах железомарганцевого аустенита.
Таким образом, особые свойства марганцевых аустенитных сталей и сплавов связаны с характером межатомного взаимодействия в их решетке.
2.4. Термодинамическая активность углерода в железе
Легирование феррита и аустенита различными элементами существенно влияет на поведение углерода (растворимость в твердом растворе, диффузионную подвижность, способность к выделению и т.д.). Наиболее полной характеристикой, определяющей поведение углерода в твердом растворе, является его термодинамическая активность.
Коэффициент термодинамической активности компонента характеризует силы связи его с атомами матрицы, т.е. его подвижность в твердом растворе, способность компонента оставаться растворенным или выделяться из раствора в другую фазу. Многие процессы фазовых превращений, протекающие в стали, определяются термодинамической активностью углерода и легирующих элементов.
Отношение коэффициентов термодинамической активности углерода в легированном и нелегированном железе представляет собой относительный коэффициент термодинамической активности углерода fc. Он характеризует влияние легирующего элемента на активность углерода в железоуглеродистом сплаве.
Если fc>1, а ln fc имеет знак «+» легирующий элемент повышает активность углерода в феррите и аустените, если же fc<1, (lnfc имеет знак «-»), то легирующий элемент, наоборот, понижает активность углерода в твердом растворе.
К настоящему времени накоплен большой экспериментальный материал по влиянию легирования на термодинамическую активность углерода в аустените и относительно мало данных об активности углерода в легированном феррите. Это связано со значительными экспериментальными трудностями определения относительного коэффициента термодинамической активности углерода в феррите из-за значительно меньшего предела растворимости углерода в нем по сравнению с аустенитом.
Физическая сущность изменения коэффициента fc как в феррите, так и в аустените одна и та же и состоит в том, что легирующие элементы, находящиеся в растворе, изменяют силы связи или прочность связи между атомами металла и углерода. Карбидообразующие элементы будут увеличивать прочность связи углерода с атомами легирующего элемента в твердом растворе, они повышают вероятность нахождения атомов углерода в междоузлиях вблизи узлов решетки, занятых атомами легирующего карбидообразующего элемента, «притягивают» к себе атомы углерода и понижают подвижность углерода в твердом растворе, т.е. уменьшают его термодинамическую активность. Некарбидообразующие элементы, замещающие атомы железа в твердом растворе, будут, наоборот, «отталкивать» атомы углерода, повышать их подвижность, т.е. увеличивают его термодинамическую активность, при этом будет проявляться тенденция к выделению углерода из твердого раствора.
Обобщенные по данным различных исследователей данные о влиянии легирующих элементов на относительный коэффициент термодинамической активности углерода в аустените приведены на рис.15.
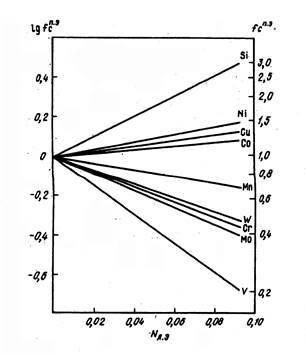
Рис. 15 - Влияние концентрации (мольной доли) Nл.с. различных легирующих элементов на относительный коэффициент термодинамической активности углерода в аустените при 1000°С
Чем сильнее карбидообразующая способность легирующего элемента, т. е. чем левее по отношению к железу находится d-переходный металл в периодической системе, тем в большей степени понижается fс <1. Некарбидообразующие элементы в аустените Со, Ni, Si увеличивают значения fс >1. Подобные данные для феррита имеются лишь по влиянию кремния.
Влияние легирующих элементов на термодинамическую активность углерода в аустените имеет большое значение в таких процессах, как растворение карбидов, нитридов и карбонитридов в аустените, выделение их из твердого раствора при охлаждении, перераспределение элементов между фазами в процессе термической обработки.
В заключение необходимо отметить, что легирующие элементы оказывают влияние на термодинамическую активность углерода в твердом растворе лишь в том случае, если они растворены в этом твердом растворе, т.е. при определении возможности протекания того или иного процесса благодаря изменению термодинамической активности необходимо учитывать содержание легирующих элементов, растворенных в твердом растворе, а не их общее содержание в стали.
2.5 Карбиды и нитриды
Основными фазами-упрочнителями в сталях являются карбиды, нитриды и комплексные соединения на их основе - карбонитриды. Физическая природа и свойства этих фаз во мцогом определяют их поведение в стали.
Общие закономерности
Карбиды и нитриды относятся к фазам внедрения и образуются при взаимодействии d-переходных металлов и соответственно углерода и азота.
Прочность связи в карбидах и нитридах между атомами металла и неметалла (межатомные силы взаимодействия) определяется строением s- и d-электронных оболочек. Для d-переходных металлов характерна (по Полингу) «гибридизация» электронов между d- и 5-орбиталями, т. е. взаимопереходы электронов с одного уровня на другой. Незавершенность строения этих электронных оболочек способствует тому, что эти металлы восприимчивы к приобретению электронов из других источников. Такими источниками - донорами электронов для переходных металлов - становятся атомы внедрения углерода и азота, имеющие соответственно четыре или три электрона.
Прочность связи между атомами металла и неметалла в карбидах и нитридах характеризуют теплотой образования ΔH298K, кДж/(г-атом) и свободной энергией образования ΔG298K, кДж/(г-атом) фаз, температурой их плавления и структурно-нечувствительными упругими свойствами. Наиболее высокие значения из указанных свойств имеют карбиды и нитриды элементов IV и V групп. По мере увеличения номера группы свойства изменяются в сторону уменьшения прочности связи атомов в карбиде и нитриде или, как говоря, прочности или стойкости карбидов и нитридов.
Следовательно, переходные металлы по их сродству к углероду и азоту, прочности и стойкости карбидов и нитридов, их устойчивости к распаду можно расположить в следующий убывающий ряд: Hf, Zr, Ti, Та, Nb, V, W, Mo, Cr, Mn, Fe.
Карбиды и нитриды металлов IV - V групп
Металлы этих групп образуют однотипные монокарбиды, мононитриды типа МеС (МеN), имеющие кристаллическую г.ц.к. решетку типа NaCl. Эта решетка представляет собой две г.ц.к. подрешетки: металлическую и неметаллическую, как бы вставлены одна в другую со смещением на половину параметра. Атомы углерода заполняют октаэдрические поры. Характерной особенностью таких структур является то, что не все октаэдрические поры заполнены атомами внедрения, некоторые из них остаются вакантными. Вследствие этого фазы МеС не имеют строго стехиометрического состава и формулы в общем виде будут иметь вид МеСх, где х < 1. Такие фазы имеют область гомогенности, т.е. их кристаллическая решетка и тип фазы сохраняются в определенной области концентраций, отличающейся от стехиометрического состава. Ниже приведены области гомогенности некоторых карбидов и нитридов: TiC1.0..0.28; ZrC1.0..0.28; HfC1.0..0.56; VC0.96..0.75; NbC1.0..0.7; TaC0.9./.0.58; TiN1.2..0.38; ZrN1.0...0.55; HfN1.1...0.74; VN1.0...0.72. В некоторых нитридах MeN возможны значения x>1, что может быть обусловлено меньшими по сравнению с углеродом размером атомного радиуса азота и возможностью его размещения в тетраэдрических порах подрешетки металла.
Из изложенного следует, что встречающиеся в литературе обозначения карбидов ванадия и ниобия в стали формулами V4C3 и Nb4C3 следует рассматривать как фазу типа МеСx при х = 0,75.
Вакантные места в решетке таких соединений могут быть заняты другими атомами внедрения (в частности, кислородом). В этих случаях карбиды и нитриды будут комплексными соединениями – карбооксидами, оксинитридами.
Однотипность связей у фаз внедрения, наличие значительного числа вакансий в их решетках способствуют образованию многокомпонентных твердых растворов. Так, почти все монокарбиды и мононитриды образуют друг с другом неограниченные твердые растворы, и в сталях обычно обнаруживается формирование комплексных карбонитридных фаз. Взаимная растворимость фаз внедрения определяется, так же как и для металлов, правилом Юм-Розери, т.е. должен соблюдаться изоморфизм кристаллических решеток; параметры их должны различаться не более чем на 15 %; в случае близости размеров атомов и одинаковой кристаллической решетки одновременно выполняется условие близости типа связи и электронной структуры фаз внедрения.
Комплексные соединения карбидов и нитридов - карбонитриды - обозначают формулой, в которой находятся все элементы, входящие в состав. Так, карбонитрид ванадия может быть обозначен V(С,N). Карбиды и нитриды на основе двух и даже трех металлов могут быть обозначены (V,Nb)C или (V,Nb,Ti)N, а карбонитриды (V,Nb)(С,N) или (V,Nb,Ti)(С,N).
Карбиды и нитриды металлов VI - VIII групп
Как уже отмечалось, все переходные металлы этих групп образуют в стали по 2-3 карбида с различной сложной кристаллической структурой. Карбиды WC и МоС и карбиды W2C и Мо2С имеют соответственно простую и плотноупакованную гексагональные решетки. Область гомогенности этих карбидов невелика, они могут взаимно растворяться. Особо важное значение эти карбиды имеют в быстрорежущих сталях.
Карбид Сr7С3 образуется чаще всего в конструкционных сталях с относительно невысоким содержанием хрома (до 3-4 %). Этот карбид имеет сложную гексагональную решетку с 80 атомами на одну элементарную ячейку (56 атомов металла и 24 атома углерода).
В сталях этот карбид может содержать от 30 до 50 % Сг, т.е. его формула должна быть в пределах Fе4Сr3С3 и Fe2Cr5C3. Обычно такой карбид обозначают (Cr,Fe)7C3 или Ме7С3.
Карбид Сr23С6 образуется в высоколегированных хромистых сталях при высоком содержании хрома (выше 5...8 %). Он имеет сложную г.ц.к. решетку, элементарная ячейка которой содержит 116 атомов, в том числе металла 92 атома и углерода 24. В сталях этот карбид в чистом виде не встречается, а часть атомов металла в нем будет замещаться элементами, входящими в состав стали (Fe, Mo, W).
Железо широко замещает в этом карбиде хром, но так как размер атомов железа несколько меньше размера атомов хрома, то начиная с определенного момента (после замещения ~30 % Сr) эти узлы становятся слишком просторными, и для устойчивости решетки необходимо присутствие крупных атомов W (или Мо). Атомы W(Mo) занимают также определенные позиции в решетке карбида Me23С6, поэтому их максимальное число в элементарной ячейке составляет. 8 из 92 атомов металла. Дальнейшее увеличение при старении стали количества вольфрама и молибдена в выделяющейся фазе сверх этого предела приводит к переходу Me23С6 к Ме6С, как к следующему карбиду, способному вместить относительно большее количество Мо и W.
Нитрид CrN образуется в сталях с азотом (аустенитные нержавеющие), имеет г.ц.к. решетку типа NaCl, аналогичную решетке нитридов IV и V групп и соответственно подобные им свойства.
Карбид Ме6С (η-карбид) содержит несколько металлов, поэтому он является комплексным карбидом. Карбид Ме6С имеет сложную растянутую гранецентрированную кубическую кристаллическую решетку, элементарная ячейка которой содержит 112 атомов, из них 96 атомов металла и 16 углерода. Обычно η-карбид образуется в высоколегированных быстрорежущих сталях с высоким содержанием молибдена и вольфрама. В сложнолегированных сталях атомы металла могут замещаться различными легирующими элементами (Me-W, Mo, Cr, Mn, Fe, Co и др.), поэтому они чаще обозначаются как Ме6С, а в более конкретных случаях, например, (W, Mo, Fe)6C.
Карбиды железа относятся к наименее стойким по сравнению с карбидами легирующих элементов. Основным карбидом железа является цементит Fe3С, промежуточным карбидом в сталях ε-карбид, а в некоторых высокоуглеродистых сплавах η- и χ-карбиды.
Цементит Fe3С является основной структурной составляющей стали, образующейся при перлитном превращении, в процессе бейнитного распада, при отпуске мартенсита и других процессах. Цементит имеет сложную ромбическую решетку, элементарная ячейка которой содержит 96 атомов (Fe - 72, С - 24). Для структуры цементита характерна плотная упаковка атомов железа с расположенными в междоузлиях атомами углерода, по этому признаку структура может быть охарактеризована как близкая к структуре аустенита. Поэтому между Fe3С и γ-железом имеется хорошее ориентационное и структурное соответствие. Хорошее сопряжение наблюдается также и для решеток Fe3С и α-железа.
Атомы железа в цементите могут замещаться атомами некоторых легирующих элементов. Так, неограниченно растворим в цементите марганец, при этом карбид будет иметь формулу (Fe, Мn)3С. Неограниченная растворимость марганца в цементите объясняется тем, что марганец образует карбид Мn3С, подобный Fe3C. Растворимость хрома в цементите составляет около 20 %. Легированный хромом карбид будет иметь формулу (Fe, Сг)зС. Хром и марганец повышают устойчивость цементита в стали. Растворимость молибдена в цементите значительно меньше, так как более крупные атомы молибдена способны лишь к неустойчивому замещению атомов железа. В этом случае устойчивость цементита понижается. Такие легирующие элементы, как V, Nb, Ti, Zr, практически нерастворимы в цементите.
Карбиды марганца, как самостоятельные, в сталях практически никогда не образуются, так как их состав и кристаллические решетки подобны соответствующим карбидам хрома и железа, и они образуют с ними комплексный карбид, в состав которого входит марганец, например: (Fe, Cr, Mn)23C6 , (Fe, Cr, Mn)7C3, (Fe, Mn)3C.
2.6 Интерметаллиды
Фазы, образующиеся в результате взаимодействия основного компонента сплава с легирующими элементами или легирующих элементов между собой, называются интерметаллическими соединениями или интерметаллидами.
В настоящее время в сплавах обнаружено примерно 1300 интерметаллических соединений, которые кристаллизуются в 200 типов структур.
Отличительным признаком интерметаллических соединений является наличие у них новой кристаллической решетки, отличной от решеток, составляющих фазу компонентов.
Важно отметить, что структура, устойчивость, температурные и концентрационные области существования интерметаллидов определяются совокупным действием электронной структуры, электрохимического и размерного факторов.
Интерметаллиды оказывают определяющее влияние на упрочнение в аустенитных и мартенситностареющих сталях, многих жаропрочных сплавах на никелевой и кобальтовой основах, а также на свойства жаростойких защитных покрытий. В ряде жаропрочных сплавов содержание интерметаллических фаз может достигать 55-65 %.
В перечисленных материалах различают следующие группы интерметаллических соединений: электронные соединения, σ-фазы, фазы Лавеса, геометрически плотноупакованные фазы.
Электронные соединения
Электронные соединения или фазы Юм-Розери имеют характерные для металлических элементов структуры типа о.ц.к., г.ц.к., г.п.у. В этих соединениях структура образующихся фаз в основном определяется электронной концентрацией, т.е. отношением числа валентных электронов к числу атомов в элементарной ячейке. При образовании этих соединений металлы переходных групп обнаруживают переменную валентность, что обусловлено перекрытием d- и s-уровней.
При отношении числа валентных электронов к числу атомов в решетке, равном 3/2, интерметаллические соединения образуют β-фазы с о.ц.к. структурой или со сложной кубической решеткой. К ним относятся, например, алюминиды переходных металлов - FeAl, CoAl и NiAl и сплавы на их основе. Перечисленные интерметаллиды обладают металлическими свойствами, однако участие d-электронов в межатомной связи предопределяет появление ковалентной составляющей.
Свойства интерметаллидов этого типа можно проиллюстрировать на примере моноалюминида никеля и твердых растворов на его основе. Моноалюминид никеля NiAl характеризуется высокой температурой плавления (1638 °С), большой теплотой образования, высокой энергией упорядочения. Кристаллы обладают сильной анизотропией свойств и весьма хрупки. Никельалюминиевые β-сплавы обладают высокими характеристиками прочности при повышенных температурах (до 900 - 1000 °С), высокой стойкостью против окисления и газовой коррозии, малой диффузионной подвижностью атомов в решетке, обеспечивающей стабильность структуры до высоких температур. Эти свойства позволяют использовать данные соединения в качестве жаропрочных и жаростойких материалов и покрытий.
В промышленных сталях и сплавах, которые являются сложнолегированными многокомпонентными системами, интерметаллические соединения, особенно однотипные, могут образовывать широкие области твердых растворов, свойства которых значительно изменяются. Так, в сплавах Fe-Ni-Al имеется широкая область гомогенных β-фаз между двойными соединениями Fe-Al и Ni-Al.
При увеличении в электронных соединениях содержания многовалентного элемента происходит изменение симметрии решетки: при концентрации электронов на атом 21/13 образуется, структура γ-латуни, содержащая 27 деформированных о.ц.к. ячеек, а при концентрации 7/4 - ε-латуни с гексагональной плотноупакованнοй структурой. Эти фазы встречаются в цветных и прецизионных сплавах.
Сигма-фазы
σ-фазы и родственные им соединения образуются переходными металлами и имеют тетрагональные или сложные ромбоэдрические элементарные ячейки, структура которых характеризуется наличием плотноупакованных слоев атомов, смещенных по отношению друг к другу и расположенных на относительно больших расстояниях. Такие фазы и родственные им соединения иногда называют топологически плотноупакованными.
Впервые σ-фаза типа FeCr была обнаружена в железохромистых сплавах как хрупкая составляющая. Она имеет тетрагональную решетку с элементарной ячейкой из 30 атомов, аналогичную решетке урана.
Как для электронных соединений, так и для σ-фаз невозможно установить определенный состав, поэтому существование этих фаз обычно связывают с определенными значениями электронной концентрации. Расчеты электронной концентрации с учетом s- и d-электронов дают 6,5...7,4 электронов/атом в большинстве известных σ-фаз, что позволяет считать эти фазы определенной группой электронных соединений. Установлено также, что σ-фазы образуются элементами при различии атомных радиусов R до 8 % (в системе Со-Мо - до 12 %).
Области существования о-фаз по концентрации и по температурам зависят от положения элементов в периодической системе Д.И. Менделеева: в системе Fe-Mo до 1400 °С, в Fe-Cr до 820 °С, выше которых они растворяются в твердом растворе. В σ-фазах двухкомпонентных систем могут легко растворяться атомы других переходных элементов.
В промышленных сталях и сплавах встречаются как σ-фазы относительно простого состава (например, в сталях типа Х25 σ-фаза типа FeCr), так и сложнолегированные композиции (например, в дисперсионно-твердеющих сложнолегированных сталях σ-фазы, содержащие Fe, Cr, Mo, Ni). В жаропрочных сплавах на никелевой основе σ-фазы имеют состав (Cr, Mo)x(Ni, Co)y, где х и у могут изменяться от 1 до 7.
Выделение σ-фазы происходит при длительных выдержках в интервале температур 500...900 °С и является причиной сильного охрупчивания сталей и сплавов, уменьшает их пластичность и прочность.
Возможно существования σ-фаз в двойных системах d-nepeходных металлов Cr-Fe, Cr--Mn, Cr-Co; V-Mn, V-Fe, V-Co, V-Ni; Mo-Fe, Mo-Co.
Кинетика образования σ-фаз обычно описывается С-образной кривой (рис. 16), положение которой определяется составом сплава и его предысторией (литое или деформированное состояние, режим предварительной термической обработки, напряженное состояние и т. д.).
Вредное действие σ-фаза оказывает на жаропрочные сплавы. Из-за присутствия σ-фазы резко снижается длительная прочность, так как большие количества тугоплавких элементов-упрочнителей выводятся из матрицы сплава. Кроме того, разрушение при повышенных температурах происходит предпочтительно вдоль границ σ-фазы, которые служат источниками зарождения и распространения трещин, ведущих к хрупкому разрушению.
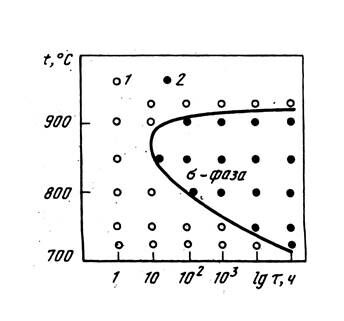
Рис. 16 – Изотермическая диаграмма образования σ–фазы в жаропрочном сплавена никелевой основе:
1 - σ-фаза отсутствует; 2 - σ-фаза выделяется.
Фазы Лавеса
Интерметаллические соединения состава А2В называют фазами Лавеса. Эти фазы обычно имеют кубическую или гексагональную структуру. Они могут образовываться компонентами, расположенными в любом месте периодической системы.
Исследование большого числа фаз Лавеса показало, что основным фактором, определяющим их образование, является соотношение атомных размеров компонентов. Несмотря на главную роль размерного фактора при образовании фаз Лавеса, важное значение в их стабильности играет электронная концентрация, которая определяет, какая из возможных структур образуется, а также каковы размеры их областей гомогенности, хотя последние, как правило, незначительны.
Наиболее часто образуются в сталях и сплавах следующие интерметаллические фазы Лавеса: Fe2Al, Zr2Al, Fe2Mo, Co2 Ti, Ni2Ta, (Fe,Si)2Mo, Fe2(Ni,Nb) и др. Их присутствие часто сопровождается охрупчиванием при комнатной температуре, но менее опасно при повышенных температурах.
Более того, во многих теплостойких и жаропрочных сплавах удается использовать фазы Лавеса для упрочнения без существенного снижения вязкости и хрупкой прочности.
Геометрически плотноупакованные фазы
Эти фазы или соединения типа А3В представляют собой выделения упорядоченных г.ц.к. (γ'), о.ц.т. (γ") и гексагональных плотноупакованных η-фаз из аустенитных матриц.
Выделение этих фаз представляет собой одно из наиболее благоприятных явлений, так как оно позволяет достигать значительного упрочнения, стабильного при высоких температурах без заметного охрупчивания сплавов.
В соединениях типа А3В более электроотрицательные элементы - такие, как Fe, Co, Ni, соответствуют элементу А, а такие как А1, Ti, Nb, - элементу В. Обычно в никелевых жаропрочных сплавах основная упрочняющая γ'-фаза представляет собой соединение на основе Ni3Al.
γ'-фаза является упорядоченной, причем дальний порядок сохраняется почти до температуры плавления (1385 °С). Уникальным свойством γ'-фазы является увеличение прочности с повышением температуры в широком интервале температур: для нелегированной фазы до 800 °С, а для легированной - еще выше (рис. 17).
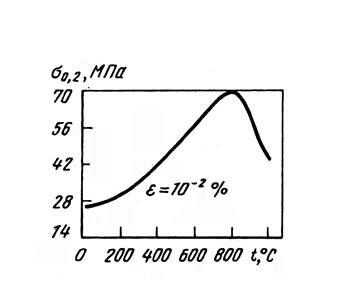
Рис. 17. – Влияние температуры испытания на предел текучести σ0,2 γ'-фазы типа Ni3(Ti, Al).
Благоприятное влияние А3В фаз на свойства сталей и сплавов связывают с их высокой пластичностью, когерентной связью с основным твердым раствором и высокой стабильностью при повышенных температурах.
Многие интерметаллические соединения обладают высокими характеристиками прочности, коррозионной стойкости, жаропрочности, износостойкости. В последнее время на их основе разрабатываются материалы для новых отраслей техники.
Таким образом, из интерметаллических фаз наиболее благоприятное влияние на упрочнение сплавов оказывают соединения типа А3В, а также некоторые фазы Лавеса. Выделение σ-фазы и ей подобных топологически плотноупакованных фаз вызывает резкое охрупчивание сплавов.
2.2 Неметаллические включения
К неметаллическим включениям относятся химические соединения, образовавшиеся в стали в процессе ее производства – выплавки и разливки. Неметаллические включения являются важнейшим фактором, характеризующим «металлургическое» качество стали. Они существенно влияют на качество и свойства стальных изделий, их эксплуатационные характеристики в зависимости от природы, количества, формы, размера и характера распределения.
Согласно классификации, все неметаллические включения по природе их происхождения можно разделить на два вида:
- Эндогенные неметаллические включения – соединения, образовавшиеся в стали в результате химических реакций, протекающих в процессе ее выплавки, раскисления и разливки, и вследствие изменения растворимости примесей в прроцессе кристаллизации слитка.
- Экзогенные неметаллические включения – частицы различных соединений, попавшие в жидкую сталь или в слиток извне, в т.ч. из шихтовых материалов, огнеупорной футеровки сталеплавильных агрегатов и устройств и т.п.
Указанные неметаллические включения могут взаимодействовать между собой, образуя комплексные соединения.
Классификация неметаллических включений по составу условна, так как во многих случаях включения являются комплексными и состоят из нескольких типов химических соединений: кислородные (оксиды и силикаты), сульфиды и нитриды.
Кислородные включения наиболее многочисленны. Большинство этих включений являются продуктами раскисления стали. Они могут быть и экзогенными (частицы огнеупоров). М.И. Виноград разделяет их на четыре вида:
1. Простые оксиды: А12Оз - оксид алюминия (корунд, глинозем); SiO2 - диоксид кремния (кварц, кремнезем); FeO - оксид железа (II): Fe2O3 - оксид железа; ТiO2 - диоксид титана; Сг2О3 - оксид хрома и др.
2. Сложные оксиды (шпинели): FeO*MnO - оксид железа (II) и марганца (II); FeO*Сг2О3 - хромиты; FeO*V2O5 - ванадиты; FeO*Ti2O5 - ильменит; FeO*Al203 - герцинит; MgO*Al2O3 – магнезиальная шпинель; СаО*А12О3 - алюминат кальция.
3. Силикаты и алюмосиликаты (кристаллические):2FeO*SiO2 - силикат железа (файялит); 2MnO*SiO2 - силикат марганца (тефроит): mCaO*nSiO2 - силикат кальция; 3Al2O3*2SiO2 алюмосиликат муллит; Al2O3 SiO2- алюмосиликат силлиманит.
4. Стекла. Не имеют кристаллического строения. Обычно в их составе содержится кремнезем. Наиболее часто встречаются кварцевое стекло, силикатные стекла с примесью оксидов алюминия, марганца, хрома и др.
Различные типы кислородных неметаллических включений приведены на рис. 18.
Сульфидные включения образуются при затвердевании стали вследствие того, что растворимость серы в жидкой фазе значительно выше, чем в твердом растворе.
В сталях в основном образуются сульфиды железа и марганца - FeS и MnS. Сульфид железа FeS имеет температуру плавления 1188 °С, однако в стали он образует легкоплавкую эвтектику (988 °С). Сульфид марганца MnS имеет температуру плавления 1620 °С, т.е. выше температуры плавления стали.
Из-за того, что сера имеет большее сродство к марганцу, чем к железу, в сталях при наличии определенного содержания марганца предпочтительнее образуется сульфид марганца или комплексный сульфид (Mn, Fe)S, имеющий состав: 60...62 % Мп; 34...35 % S и 2...3%Fe.
Легирующие элементы также могут образовывать сульфиды в стали. Никель и кобальт образуют легкоплавкие нестойкие сульфиды, а сульфиды хрома, циркония, титана, ниобия, ванадия более тугоплавки.
Обратите внимание на лекцию "24 Литургия верных".
Кристаллизация сульфидов в стали зачастую происходит на подложках оксидов, при этом комплексные включения называются окси-сульфидами (например, FeO MnS; FeO*SiO2 *MnS). Некоторые сульфидные включения в горячекатаной стали показаны на рис. 18, д, е.
Нитриды можно отнести к неметаллическим включениям лишь условно, да и то в ограниченных случаях. Будем относить их к ним только в том случае, когда они являются продуктом соединения остаточного азота в стали (менее 0,008 %) с нитридообразующими элементами (прежде всего с титаном и алюминием), попавшими в сталь случайно в небольших количествах (до 0,02...0,03 %) либо введенных в сталь с раскислителями.
Нитриды нельзя считать неметаллическими включениями в тех случаях когда нитридообразующие элементы (Ti, Zr, V, Nb, Al и др) вводят в сталь как легирующие добавки, либо совместно с ними вводится в сталь повышенное, в сравнении с остаточным, содержание азота (более 0,01 %), а образующиеся при этом нитриды и карбонитриды придают стали специальные свойства.
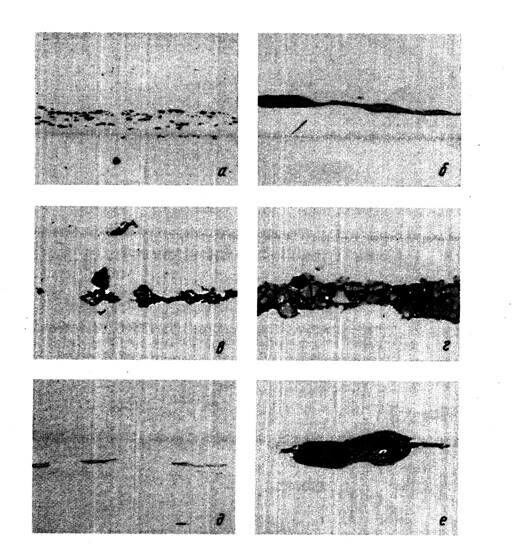
Рис.18 – Кислородные (а-г) и сульфидные (д, е) неметаллические включения в деформированной стали:
а – глиноем; б – силикаты пластичные; в – силикаты хрупкие; г – сложные оксиды; д – сульфиды; е – оксисульфиды.




















