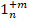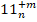Энтропийный метод анализа термодинамического совершенства процессов и циклов
Лекция 6.
Энтропийный метод анализа термодинамического совершенства процессов и циклов.
Термодинамический цикл ХМ складывается из нескольких процессов. Необратимые процессы приводят к увеличению работы цикла. Минимальная работа цикла будет иметь место если все процессы цикла обратимы.
Согласно теореме Гюи-Стодолы приращение работы цикла равно произведению температуры ОС на сумму приращений энтропии всех тел принимающих участие в процессе (приращение энтропии характеризует степень необратимости процесса)

Энтропийный метод анализа осуществляется путем рассмотрения влияния изменения энтропии в отдельных процессах, на энтропию системы в целом.
Поскольку энтропия является параметром состояния рабочего вещества, то в замкнутом цикле с совершенным рабочим веществом его энтропия примет первоначальное значение в исходной точке цикла, независимо от прироста энтропии в отдельных процессах. Поэтому необратимые потери и рост энтропии цикла можно определить только сравнивая данные (анализируемые необратимый цикл), состоящие из необратимых процессов с эквивалентным обратимым циклом-образцом, состоящим из обратимых процессов.
Эквивалентность обратимого цикла-образца определяется тем, что он имеет одинаковые с анализируемым циклом температуры источников Тинт, Тивт и одинаковую холодопроизводительность (для теплового насоса – теплопроизводительность). Работа эквивалентного обратимого цикла будет минимальной для заданных условий (температур), что позволяет при сравнении с работой необратимого цикла определить коэффициент обратимости последнего.

Рекомендуемые материалы

В общем случае цикл ХМ состоит из процесса сжатия рабочего вещества с более низкого давления до более высокого, расширения рабочего вещества и двух процессов теплообмена с источниками ИВТ и ИНТ.
Процессы сжатия и расширения обратимы если они проходят по изоэнтропе. Процессы теплообмена с источниками обратимы, если изменение температуры источника и рабочего вещества совпадают.
Обратимые (обратные) циклы.
1. Цикл Карно.

Если источники в процессе теплообмена с рабочим веществом свою температуру не изменяют, т.е. они const, то минимальная работа при получении холода затрачивается в цикле Карно, состоящего из двух изотерм и двух изоэнтроп.

1 – 2 – сжатие рабочего вещества;
2 – 3 – охлаждение (отвод тепла);
3 – 4 – расширение рабочего вещества;
4 – 1 – подвод тепла.
Характеристика этого цикла.









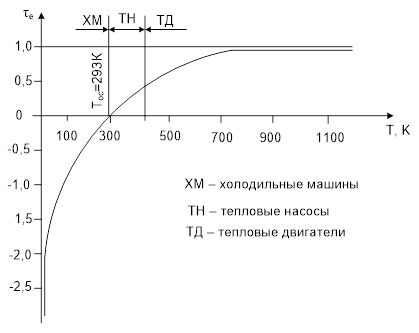
Холодильный коэффициент цикла Карно не зависит от свойств рабочего вещества, а зависит только от абсолютной температуры источников.
 возрастает при увеличении Тинт и при уменьшении Тос. Влияние Тинт преобладает.
возрастает при увеличении Тинт и при уменьшении Тос. Влияние Тинт преобладает.
2. Цикл Лоренца.
Применяется в качестве эквивалентного обратного цикла, если источники (ИНТ, ИВТ, ОС) в процессе теплообмена с рабочим веществом свою температуру изменяют.
Применение цикла Карно в этих условиях неудовлетворяет условиям эквивалентности. Цикл Лоренца состоит из двух изоэнтроп (расширение и сжатие) и двух процессов отражения изменения температуры источника.

Цикл с переменной температурой источников может быть представлен как сумма элементарных циклов Карно, в пределах которых температуры  ,
, постоянны. Тогда холодопроизводительность цикла эквивалентна площади в-1-4-а.
постоянны. Тогда холодопроизводительность цикла эквивалентна площади в-1-4-а.





1. Обобщенный цикл Карно.

В некоторых случаях цикл-образец с процессами сжатия и расширения по изоэнтропе (S=const) неудобен, например при анализе регенеративных газовых циклов (цикл Линде). В этом случае один из процессов 1-2 или 3-4 может быть заменен на любой, например изобару p=const, но должно быть выполнено условие, что изменение энтропии в процессах 1-2 и 3-4 должно быть одинаково.
В этом случае холодильный коэффициент  обратимого цикла будет равен холодильному коэффициенту
обратимого цикла будет равен холодильному коэффициенту  цикла Карно.
цикла Карно.
Оценка необратимых потерь при теплообмене рабочего вещества и ИНТ
(внешняя необратимось).

Требуется охладить ИНТ от Тинт1 (а) до Тинт2 (в). Между Тинт и Траб. вещ-ва имеется разность температур (температурный напор). Отвод тепла в окружающую среду обратимый (Траб. вещ-ва и Тос совпадают). Процессы сжатия и расширения обратимы.
Цикл а-с-3-в – это цикл обратимый, если бы теплоотвод в процессе а-в был бы обратимым. Для решения поставленной задачи пл. а-с-3-в выражает минимальную работу. Принимаем, что процесс рабочего вещества проходит по изотерме.
Количество тепла, которое отводится от ИНТ, эквивалентно площади е-а-в-т.


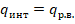
Рабочее вещество реализует цикл 1-2-3-4



Общая площадь – е-5-4-т

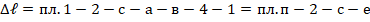
Прирост энтропии рабочего вещества 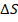
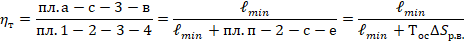
Базовый цикл парокомпрессионных ХМ и энтропийный анализ его термодинамического совершенства.

Параметры базового цикла – Т1
1-2 – сжатие в КМ
2-3 – процесс в конденсаторе
3-4 – дросселирование (от Рк до Р0)
4-1 – кипение в испарителе (И)
Признаки
Сжатие из состояния насыщения (сухой насыщенный пар) по S=const, дросселирование из состояния насыщенной жидкости.

Процесс сжатия по S=const характерно 



 Работа пропорциональна
Работа пропорциональна  в степени
в степени  и начальной температуре Т1
и начальной температуре Т1

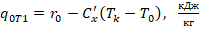
 - средняя теплоемкость насыщенной жидкости в интервале от Тк до Т0.
- средняя теплоемкость насыщенной жидкости в интервале от Тк до Т0.

Приведенная теплоемкость насыщенной жидкости -

 - теплота парообразования
- теплота парообразования
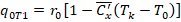
Энтропийный анализ этого цикла.
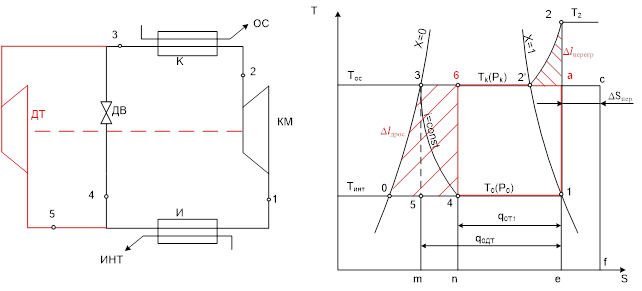
1-2-2’-3-4 – базовый цикл Т1.
Цикл внешне обратим, Тос совпадает с температурой конденсации Тк, и Тинт совпадает с температурой кипения То.
1-а-в-4 – рабочий цикл Карно.
Замечание. Цикл соответствует схеме с детандером. Этим условиям соответствует 1-2-2’-3-5 – схема с детандером и расшире6нием по изоэнтропе.
Работа детандера эквивалентна площади 5-3-0. В базовом цикле детандер отсутствует и не возвращается его работа 3-5-0. Процесс расширения в детандере заменен на процесс дросселирования 3-4, который сопровождается необратимыми потерями и снижением холодопроизводительности.
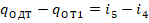
При этом работа сжатия остается неизменной и эквивалентна площади 1-2-2’-3-0-1.
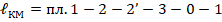
В сравнении с эквивалентным циклом Карно прирост работы

Кроме того, в сравнении с эквивалентным циклом имеется, 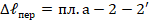
В базовом цикле присутствуют 2 вида внутренних необратимых потерь: потери от замены детандера дроссельным вентилем  , и потери от нагрева пара в процессе сжатия до Т2, выше температуры конденсации Тк.
, и потери от нагрева пара в процессе сжатия до Т2, выше температуры конденсации Тк.
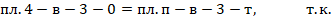
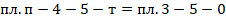
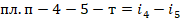





В конденсаторе отводится тепло пропорциональное
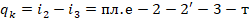
Это тепло должно быть отведено к окружающей среде.


Отсюда последует, что

Инженерный способ определения необратимости.!!!!!!!

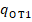

 ⇒
⇒

По холодильному коэффициенту базового цикла Т1 судят об эффективности данного холодильного агента. Для разных хладагентов различая  укладываются в предел (15
укладываются в предел (15 20)%. В зависимости от теплофизических свойств для одних хладагентов при этом преобладают потери
20)%. В зависимости от теплофизических свойств для одних хладагентов при этом преобладают потери  и меньше потери
и меньше потери  . Для других холодильных агентов напротив. Большие потери
. Для других холодильных агентов напротив. Большие потери  зависят от наклона левой пограничной кривой в координатах
зависят от наклона левой пограничной кривой в координатах  и характеризуется величиной
и характеризуется величиной  . Чем больше эта величина, тем больше потери дросселирования.
. Чем больше эта величина, тем больше потери дросселирования.
Эксергетический метод анализа термодинамических систем.
Поиск путей совершенствования термодинамических систем обуславливает применение различныхметодов анализа. Наряду с энтропийным применяют эксэргетический метод анализа как для прямых, так и для обратных циклов.
1. Эксергия – это часть энергии, которая при обратимом взаимодействии с окружающей средой может быть полностью превращена в работу или другие виды энергии.
2. Эксергия – максимальная внешняя работа, которая может совершить система при обратимом взаимодействии с окружающей средой.
3. Эксергия может быть определена как работоспособность тепла.
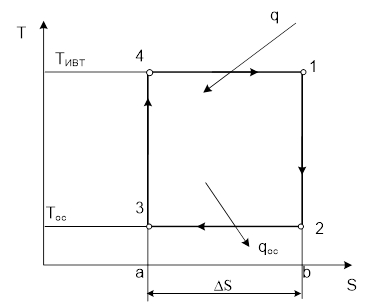
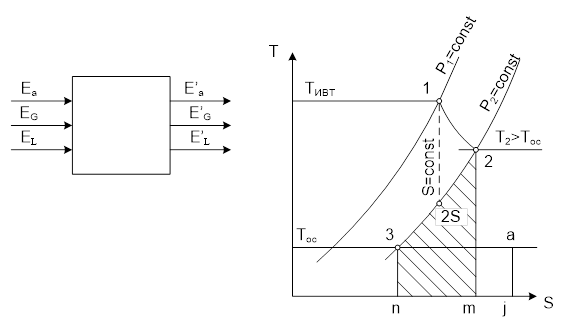
1-2-3-4 – цикл по часовой стрелке ⇒ прямой цикл.
1-2 – расширение рабочего вещества с производством работы.
2-3 – отвод тепла в ОС.
3-4 – сжатие рабочего вещества.
4-1 – подвод тепла с Тивт.
1-2 и 3-4 – изоэнтропы.
Считаем, что процессы 4-1 и 2-3 обратимы (т.е. Тисточников неизменны, Траб. вещ-ва совпадает с Тисточников).
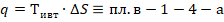
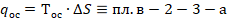
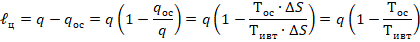
В соответствии со II законом термодинамики, для работы термодинамической системы необходим не только подвод тепла, но и отвод тепла, следовательно подведенное тепло  не может быть полностью превращено в работу.
не может быть полностью превращено в работу.
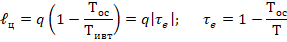
Т – рабочая температура рассматриваемой системы.
 – эксергетическая температурная функция. В рассматриваемом примере она оценивает какая часть подведенной тепловой энергии может быть превращена в работу.
– эксергетическая температурная функция. В рассматриваемом примере она оценивает какая часть подведенной тепловой энергии может быть превращена в работу.
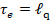
Покажем, что эксергетическая температурная функция  равна КПД прямого цикла Карно.
равна КПД прямого цикла Карно.
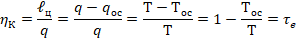
Эксергетический метод основан на вычислении потерь энергии в отдельных процессах и в цикле в целом. В начале определяют эсергию, т.е. отсекают ту часть энергии, которая не может быть превращена в работу. Затем, если процессы необратимые, вычисляют потери эксергии. Энергия никогда не может быть равной 0 на каком бы температурном уровне она не присутствовала. Эксергия может быть равна 0. Так  .
.
Такие виды энергии как: механическая, электрическая, магнитная, гравитационная – могут быть, в принципе, полностью превращены в работу, т.е. для них эксергия и энергия совпадают между собой.


 Теплота и энергия потока вещества могут быть превращены в работу только частично.
Теплота и энергия потока вещества могут быть превращены в работу только частично.
 Если имеется источник с температурой ниже Тос, то в обратимом взаимодействии с окружающей средой также может быть произведена работа.
Если имеется источник с температурой ниже Тос, то в обратимом взаимодействии с окружающей средой также может быть произведена работа.
Для этого случая вводится понятие «эксергия холода», которая равна минимальной работе, затрачиваемой для осуществления обратного термодинамического цикла.
Эксергию обозначают буквой Е большое, она имеет ту же размерность, что и тепло - [ ]. Удельная эксергия е - [
]. Удельная эксергия е - [ ].
].
Различают: эксергия тепла ЕQ; эксергия потока ЕG; эксергия работы ЕL.
При эксергетическом анализе составляют балансы эксергии на входе и выходе, анализируемого участка системы. Например, на входе: ЕQ + ЕG + ЕL ≥ ЕQ’ + ЕG’ + ЕL’.
Знак «>» если процессы необратимые. Иначе можно записать: 
 - характеризует величину потерь эксергии.
- характеризует величину потерь эксергии.

 – эксергетический КПД.
– эксергетический КПД.
Графическое изображение эксергетической температурной функции.
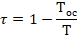
Оценка эффективности потока.
1-2S – расширение по изоэнтропе;
1-2 – расширение с потерями отклонения по S=const.
В результате расширения мы получим некоторое количество работы, характеризующееся разностью энтальпий  , однако поток рабочего вещества после расширения имеет
, однако поток рабочего вещества после расширения имеет  и если мы не сможем эту температуру полезно использовать, то остальную часть энергии, до равновесия с окружающей средой, мы потеряем. Это потерянное тепло отдается окружающей среде. Если мы построим прямоугольник, то
и если мы не сможем эту температуру полезно использовать, то остальную часть энергии, до равновесия с окружающей средой, мы потеряем. Это потерянное тепло отдается окружающей среде. Если мы построим прямоугольник, то
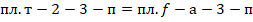
Потери будут равняться  .
.
Баланс:
Если мы подведем 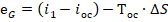





Эксергетический баланс ХМ.
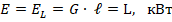

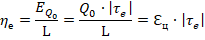
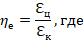
 – холодильный коэффициент цикла;
– холодильный коэффициент цикла;
 – холодильный коэффициент цикла Карно.
– холодильный коэффициент цикла Карно.
Использование эксергетического КПД  необходимо при оценке эффективности систем одновременно вырабатывающих несколько потоков энергии. Например ХМ, вырабатывающая холод на двух и более уровнях температур, или система, вырабатывает одновременно холод и тепло (см. классификацию циклов). Поскольку эксергетический метод анализа определяет термодинамическую ценность каждого потока энергии, то складывая эксергии каждого потока мы можем определить общий эксергетический КПД системы.
необходимо при оценке эффективности систем одновременно вырабатывающих несколько потоков энергии. Например ХМ, вырабатывающая холод на двух и более уровнях температур, или система, вырабатывает одновременно холод и тепло (см. классификацию циклов). Поскольку эксергетический метод анализа определяет термодинамическую ценность каждого потока энергии, то складывая эксергии каждого потока мы можем определить общий эксергетический КПД системы.
Пример. Система вырабатывает холод Q01 с температурой Тинт1=243К (t0=-30оC), второй поток холода Q02 с температурой Тинт2=268К (t0=-5oC), и вырабатывает тепло Qk с температурой Тивт=333К (t0=60oC). Известна затраченная мощность L, кВт.
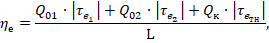

Чем больше отклонение рабочей температуры от Тос, тем более высока термодинамическая ценность данного потока энергии.
IV Рабочие вещества ХМ.
Общие сведения:
Перенос тепла с более низкого уровня температуры на более высокий, осуществляет рабочее вещество (холодильный агент) циркулирующее обычно в замкнутом контуре ХМ или ТН реализуя обратный термодинамический цикл.
Наиболее распространены хладагенты с нормальной температурой кипения, значительно ниже Тос.
Первые ХМ были построены и применены во второй половине XIX в. В то время использовались: диоксид углерода CO2 c ts=-78oC; сернистый ангидрид SO2 c ts=-10oC; хлористый метил CH3Cl c ts=-29,7oC; амиак NH3 c ts=-33oC. Каждый из этих хладагентов имел существенные недостатки, что весьма осложняло эксплуатацию ХМ, т.к. SO2 и CH3Cl – весьма токсичны; применение CO2 – связано с высокими давлениями ХМ; NH3 – также токсичен и пожароопасен. В 20-х годах XX в. были синтезированы «фреоны», а это есть – хлорфтор замещенные углеводороды, на основе: метана CH4, этана C2H6, пропана C3H8.
Фреоны вытеснели первоначально применявшиеся хладагенты, кроме амиака, и позволили поставить производство ХМ на рельсы массового производства.
Фреоны представлялись абсолютно безопасными и в отношении токсичности и в отношении взрывопожароопасности.
В 80-х годах XX в. выяснилось, что хлорсодержащие фреоны обладают потенциалом разрушения азонового слоя, а все остальные синтетические рабочие вещества являются парниковыми газами. Поэтому, в последствии 30 лет идет ревизия применения хладагентов, замена части из них, исходя из экологической безопасности, в частности расширение применения , так называемых, природных рабочих веществ, к которым относятся: амиак NH3, диоксид углерода CO2, углеводороды C2H6, C3H8; воздух и вода как рабочие вещества.
Классификация холодильных агентов:
1. Синтетические, природные. Синтетические – хлорфтор замещенные углеводороды. Природные - амиак CO2, углеводороды, воздух и вода.
2. Моновещества (МВ) и смеси: зеотропные (ЗС) и азеотропные (АС). Смеси могут быть синтетическими и природными, также многокомпонентными.
3. Нормальная температура кипения и сопряженный с ней уровень давления. Хладагенты по этому признаку делятся:
а) Холодильные агенты высокого давления с нормальной температурой кипения Ts<-50oC;
б) Хладагенты среднего давления, с -50oC< Ts<-10oC;
в) Хладагенты низкого давления Ts>-10oC.
Если при температуре t=30oC, то для:
а) р=2…7 МПа;
б) р=0,3…2 МПа;
в) р<0,3 МПа.
Связь температуры и давления хладагента в состоянии насыщения вещества: R23, R134a, R123.

Обозначения холодильных агентов.
Хладагенты обозначаются: 1) названием; 2) химической формулой; 3) стандартным шифром – этот шифр принят как международный стандарт. Шифр включает первую букву R (refregerant) и цифры.
Формулирование шифра хлорфтор замещенных углеводородов (фреонов):
| Основа | в основе цифра | р |
| Метан CH4 |
| 4-(m+n) |
| Этан C2H6 |
| 6-(m+n) |
| Пропан C3H8 |
| 8-(m+n) |
| Бутан |
Атомы водорода полностью или частично замещаются хлором или фтором, к основным цифрам добавляется число атомов.
Рекомендуем посмотреть лекцию "1.1. Понятие и характерные черты культуры".
n – число атомов фтора;
m – число незамещенных атомов водорода;
р – число атомов хлора.
CCl2F2 – R12.
R13 – метановый ряд, фтор – 3.
R142 – этановый ряд, 3 водорода, 2 фтора.