Фазовые диаграммы и твердые растворы
2. Фазовые диаграммы и твердые растворы
Фазовые диаграммы состояний являются неотъемлемой частью любого обсуждения свойств материалов в тех случаях, когда речь идет о взаимодействии различных материалов. Особенно фазовые диаграммы состояния важны в микроэлектронике, т.к. для изготовления выводов и пассивирующих слоев там приходится использовать большой набор различных материалов. Учитывая тот факт, что в производстве интегральных микросхем в тесном контакте с различными металлами находится кремний, особое внимание уделим тем фазовым диаграммам, в которых в качестве одной из компонент фигурирует именно кремний.
2.1. Типы фазовых диаграмм
Однофазовые диаграммы состояний – это графики, на которых в зависимости от давления, объем и температуры изображают фазовое состояние только одного материала. Обычно не принято рисовать трехмерный график на двумерной плоскости – изображают его проекцию на плоскость температура – давление. Пример однофазной диаграммы состояний дан на рис. 2.1.
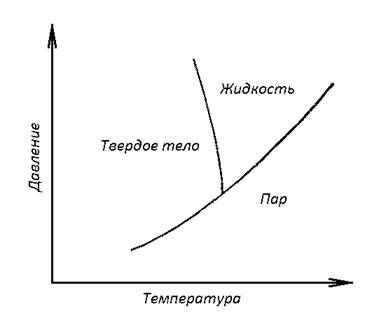
Рис. 2.1. Однофазная диаграмма состояний
На диаграмме четко разграничены области, в которых материал может существовать только в одном фазовом состоянии – как твердое тело, жидкость или газ. Вдоль разграниченных линий вещество может иметь два фазовых состояния (две фазы), находящихся в контексте друг с другом. Имеет место любая из комбинаций: твердое тело – жидкость, твердое тело – пар, жидкость – пар. В точке пересечения линий диаграммы, так называемой тройной точке, могут одновременно существовать все три фазы. Причем это возможно при одной-единственной температуре, поэтому тройная точка служит хорошей точкой отсчета температур. Обычно в качестве точки отсчета выступает тройная точка воды (например, в прецизионных измерениях с использованием термопар, где опорный спай контактирует с системой лед – вода – пар).
Двойная фазовая диаграмма (диаграмма состояния двойной системы) представляет состояние системы с двумя компонентами. На таких диаграммах по оси ординат откладывается температура, по оси абсцисс – процентное соотношение компонент смеси (обычно это или процент от общей массы (вес. %), или процент от общего числа атомов (ат. %)). Давление обычно полагается равным 1 атм. Если рассматривается жидкая и твердая фазы, измерением объема пренебрегают. На рис. 2.2. представлена типичная двухфазная диаграмма состояний для компонент A и B с использованием весового или атомного процента.
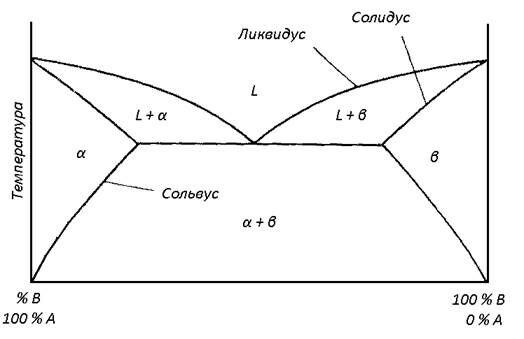
Рис. 2.2. Двухфазная диаграмма состояний
Буквой a обозначена фаза вещества A с растворенным веществом B, b означает фазу вещества B с растворенным в нем веществом A, а a + b означает смесь этих фаз. Буква (от liquid - жидкий) означает жидкую фазу, а L+a и L+b означают жидкую фазу плюс фаза или соответственно. Линии, разделяющие фазы, т. е. линии, на которых могут существовать различные фазы вещества, имеют следующие названия: солидус – линия, на которой одновременно существуют фазы a или b с фазами L+a и L+b соответственно; сольвус – линия, на которой одновременно сосуществуют фазы a и a + b или b и a + b, и ликвидус – линия, на которой одновременно существует фаза L с фазой L+a или L+b.
Рекомендуемые материалы
Точка пересечения двух линий ликвидуса часто является точкой наименьшей температуры плавления для всех возможных комбинаций веществ A и B и называется эвтектической точкой. Смесь с соотношением компонент в эвтектической точке называется эвтектической смесью (или просто эвтектикой).
Поучительно будет рассмотреть, как происходит переход смеси из жидкого состояния (расплава) в твердое и как фазовая диаграмма помогает предсказать равновесную композицию всех фаз, существующих при данной температуре. Обратимся к рис. 2.3.
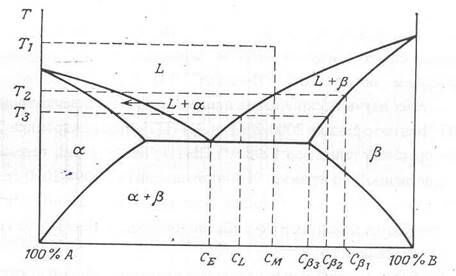
Рис. 2.3. Двухфазная диаграмма состояний, на которой показаны процессы отвердевания
Предположим, что вначале смесь имела состав CM при температуре T1, при температуре от T1 до T2 существует жидкая фаза, а при температуре T2 одновременно существуют фазы L и b. Состав присутствующей фазы L есть CМ, состав фазы b есть Cb1. При дальнейшем снижении температуры до T3 состав жидкой меняется вдоль кривой ликвидуса, а состав фазы b – вдоль кривой солидуса до пересечения с изотермой (горизонтальной линией) T3. Теперь состав фазы L есть CL, а состав фазы есть Cb2. Следует отметить, что состав Cb2 должен иметь не только вещество, перешедшее в фазу при b при температуре T3, но и все вещество, перешедшее в фазу b при более высокой температуре, должно иметь состав Cb2. Это выравнивание составов должно произойти путем твердотельной диффузии компонента A в существующую фазу b, так что к моменту достижения температуры T3 все вещество, находящееся в фазе b, будет иметь состав Cb2. Дальнейшее снижение температуры приводит нас в эвтектическую точку. В ней фазы a и b существуют одновременно с жидкой фазой. При более низких температурах существуют только фазы a и b. Образуется смесь фаз a и b состава CE с агрегатами b с начальным составом Cb3. Затем, выдерживая эту смесь длительное время при температуре ниже эвтектической, можно получить твердое тело. Образовавшееся твердое тело будет состоять из двух фаз. Состав каждой из фаз можно определить в точке пересечения изотермы с соответствующей линией сольвуса.
Только что было показано, как определить состав каждой из присутствующих фаз. Теперь рассмотрим задачу определения количества вещества в каждой фазе. Во избежания путаницы на рис. 2.4. еще раз приводится простая двухфазная диаграмма. Предположим, что при температуре T1 состав расплава есть CM (имеется в виду компонента B), тогда при T2 фаза L имеет состав CL, а фаза b будет иметь состав Cs. Пусть ML – масса вещества, находящегося в твердом состоянии, а MS – масса вещества, находящегося в твердом состоянии. Условие сохранения суммарной массы приводит к следующему уравнению
(ML + MS)CM = MLCL + MSCS.
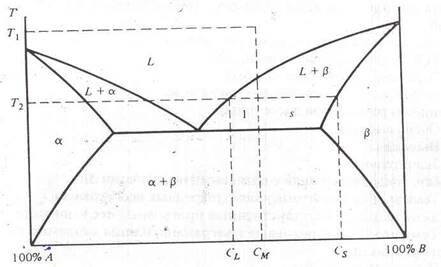
Рис. 2.4. Правило уровня
В нем нашел отражение тот факт, что общая масса вещества при температуре T1, умноженная на процент B, – есть общая масса вещества B. Она равна сумме масс вещества B, существующего в жидкой и в твердой фазах при температуре T2. Решая это уравнение, получаем
 . (2.1)
. (2.1)
Это выражение известно как “правило уровня”. С помощью этого правила, зная начальный состав расплава и общую его массу, можно определить массы обеих фаз и количество вещества B в любой фазе для любого участка двухфазной диаграммы. Точно так же можно вычислить и
На рис. 2.5. приведен еще одни пример отвердения расплава. Снижение температуры от T1 до T2 приводит к смешиванию фаз L и b с составом соответственно CM и Cb. По мере дальнейшего охлаждения состав L меняется вдоль ликвидуса, а состав b - вдоль солидуса, как было описано ранее. При достижении температуры T3 состав b станет равным CМ, и, как следует из правила уровня, при температуре, меньшей T3, жидкая фаза существовать не может. При температуре, меньшей T4, фазы a и b существуют как агрегаты фаз a и b. Например, при температуре T5 агрегаты фазы b будут иметь состав, определяемый пересечением изотермы T5 и сольвуса b. Состав a определяется аналогично – пересечением изотермы и сольвуса a.
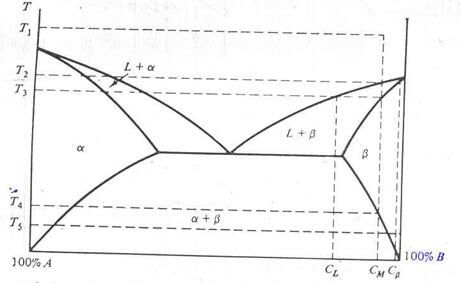
Рис. 2.5. Двухфазная диаграмма и процесс отвердевания
количество вещества A, присутствующего в любой из фаз
Участки двухфазной диаграммы, называемые до сих пор a и b, – это участки твердой растворимости: в области b растворено A и B. Максимальное количество A, которое может быть растворено в B при данной температуре, находятся в зависимости от температуры. При эвтектической или более высокой температуре может иметь место быстрое сплавливание A и B. Если полученный при этом сплав резко охладить, то атомы A могут быть “пойманы” в решетке B. Но если твердая растворимость при комнатной температуре намного ниже (это говорит о том, что при этой температуре рассматриваемый подход не слишком пригоден), то в сплаве могут возникать сильнейшие напряжения, существенно влияющие на его свойства (при наличии значительных напряжений возникают пересыщенные твердые растворы, и система находится не в равновесном состоянии, а диаграмма дает информацию только о равновесных состояниях). Иногда, такой эффект является желательным, например при упрочнении стали закалкой с получением мартенсита. Но в микроэлектронике его результат будет разрушительным. Поэтому легирование, т. е. внесение добавок в кремний до диффузии, проводится при повышенных температурах с таким расчетом, чтобы предупредить повреждение поверхности из-за избыточного сплавления. Если же количество легирующей примеси в подложке окажется выше предела твердой растворимости при любой температуре, то появляется вторая фаза и связанная с ней деформация.
2.2. Системы, имеющие важное значение в микроэлектронике
Существует ряд материалов, которые полностью растворимы друг в друге. Примером может служить система их двух таких важных для микроэлектроники веществ, как кремний и германий. Система кремний – германий показана на рис. 2.6.
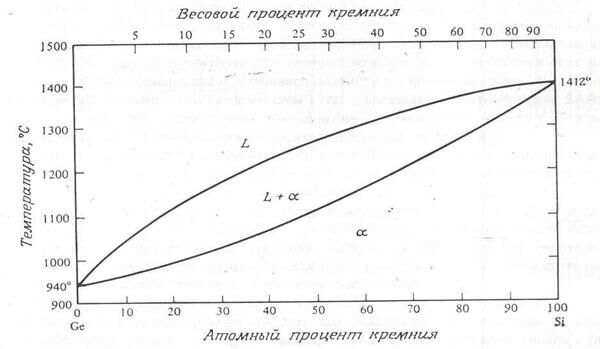
Рис. 2.6. Система кремний – германий
Диаграмма не имеет эвтектической точки. Подобная диаграмма называется изоморфной. Для того чтобы два элемента были изоморфными, они должны подчиняться правилам Хьюма – Ротери, т.е. иметь различие в значениях атомных радиусов не более чем на 15%, одинаковую вероятность, одинаковую кристаллическую решетку и, кроме того, приблизительно одинаковую электроотрицательность (электроотрицательность атома – это присущее ему семейство привлекать или захватывать лишние электроны, при ковалентных связях). Системы Cu – Ni, Au – Pt и Ag – Pd, также являются изоморфными.
Система Pb – Sn служит хорошим примером простой бинарной системы со значительной, хотя и ограниченной твердой растворимостью. Фазовая диаграмма состояний этой системы приведена на рис. 2.7. Точка пересечения солидуса и сольвуса называется граничной растворимостью, значение граничной растворимости как олова в свинце, так и свинца в олове будет большим. Данная система важна для микроэлектроники благодаря широкому применению оловянных-свинцовых припоев. Их двухфазной диаграммы этой системы видно, как изменение состава сплава меняет его температуру плавления. Когда при изготовлении микросхемы требуется провести несколько последовательных паек, то для каждой следующей пайки применяется припой с более низкой температурой плавления. Это делается для того, чтобы не потекли пайки, сделанные раньше.
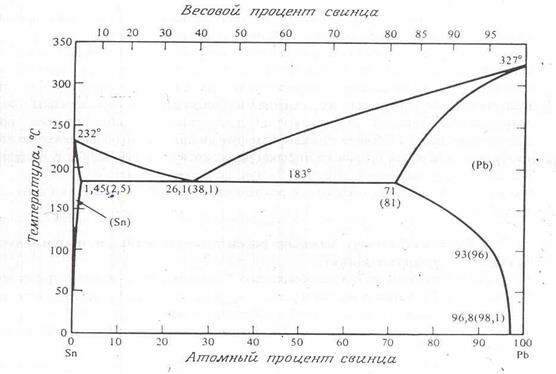
Рис. 2.7. Фазовая диаграмма состояний системы свинец – олово
Для производства микросхем также важны свойства системы Au – Si, поскольку эвтектическая температура этой системы крайне мала по сравнению с температурами плавления чистого золота или чистого кремния (рис 2.9). Растворимости золота в кремнии и кремния в золоте слишком малы, чтобы их отобразить на обычной фазовой диаграмме состояний. Из-за низкой эвтектической температуры оказывается выгодно устанавливать кристаллы микросхем на золотые подложки, держатели или платы с золотыми контактными площадками, пользуясь эвтектической реакцией Au – Si в качестве основного механизма сварки (или пайки). Для пайки кремниевых кристаллов также используется золото, содержащее несколько процентов германия.
Комбинации элементов, образующих химические соединения, имеют более сложные диаграммы состояний. Их можно разбить на две (или несколько) более простых диаграммы, каждая из которых относится к определенной паре соединений или соединению и элементов. Например, AuAl2 образуется при соединении 33% (процент атомный) золота с алюминием при температуре менее 1060о (рис. 2.10). Слева от этой линии сосуществует AuAl2 и фаза чистого алюминия. Соединения, подобные AuAl2, называются интерметаллическими и образуются при соответствующем стехиометрическом соотношении двух элементов. Интерметаллические соединения характеризуются высокой температурой плавления, сложной кристаллической структурой и, кроме того, отличаются твердостью и хрупкостью.
Фазовая диаграмма состояний Au – Al может быть разбита на две или больше диаграмм, например на диаграмму Al – AuAl2 и диаграмму AuAl2 – Au.
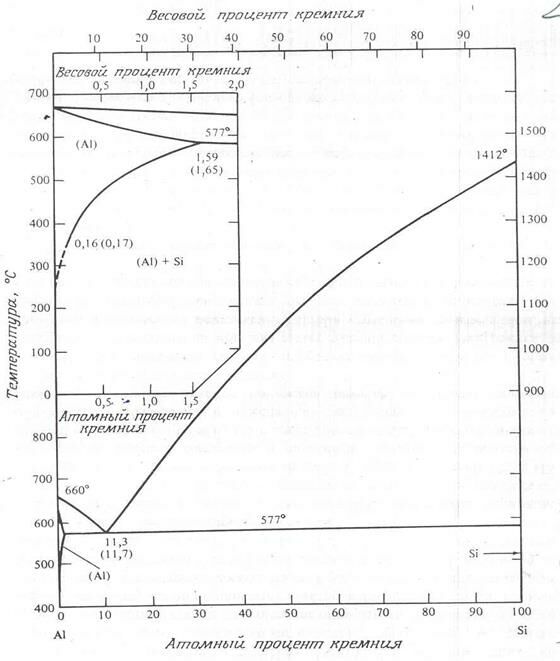
Рис. 2.8. Система алюминий – кремний
Диаграмма системы Au – Al, показанная на рис. 2.10, имеет в микроэлектронике крайне важное значение, поскольку обычно золотые провода соединяются с алюминиевым слоем металлизации, расположенным поверх кремния. Здесь указано несколько важных интерметаллических соединений: AuAl2, Au2Al, Au5Al2 и Au4Al. В проводниках связей Au – Al они могут присутствовать все. Проблемы, связанные с этими фазами, их называют пурпурной или рыжей чумой, обсуждаются в гл. 13.
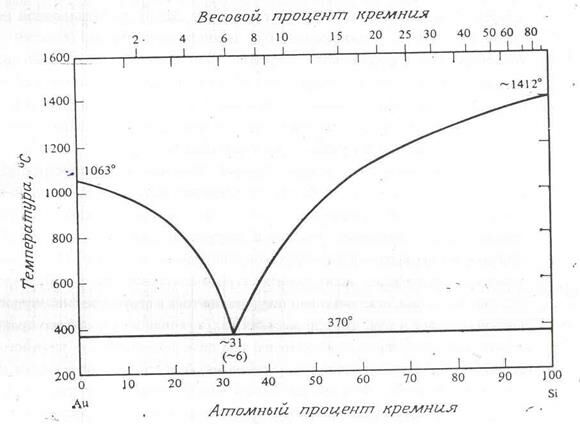
Рис. 2.9. Система золото – кремний
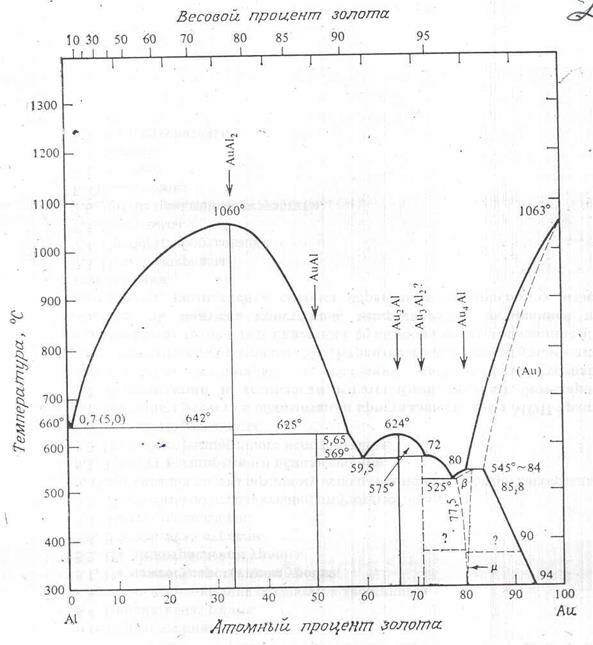
Рис. 2.10. Система золото – алюминий
2.3. Твердая растворимость
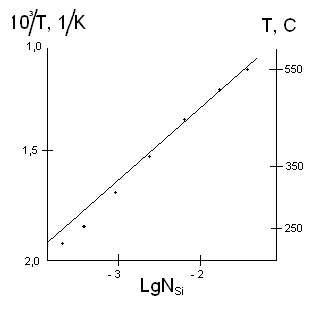
Граничная растворимость большинства легирующих примесей в кремнии крайне мала и в действительности не является максимальной растворимостью. На рис. 2.11 представлена типичная кривая солидуса для примеси без кремния. Заметьте, что растворимость растет с температурой до определенного значения, а затем убывает до нуля при температуре плавления кремния. Такая кривая называется ретроградной кривой растворимости. Уточненная версия этой диаграммы в окрестности точки плавления кремния показана на рис. 2.12.
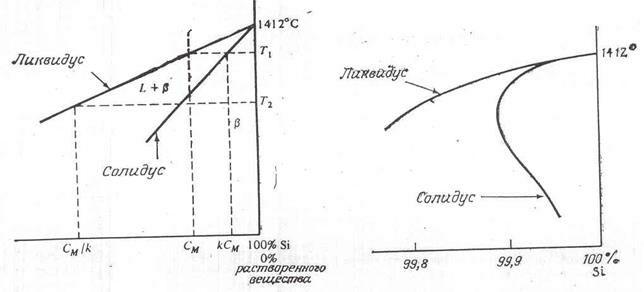
| Рис. 2.11. Ретроградная растворимость кремния | Рис. 2.12. Типичная фазовая диаграмма кремния |
Если состав расплава кремния равен CM в процентах массы растворенного вещества, то кремний будет застывать с содержанием растворенного вещества kCM, где k – коэффициент сегрегации (k=CS/CL). Когда концентрация в твердом теле достигнет значения CM при замораживании, концентрация в жидком растворе будет равна CM/k, поскольку соотношение концентраций в жидком и твердом растрах должна быть равна k. Наклон линии солидуса, следовательно, равен
 ,
,
а наклон ликвидуса равен
 .
.
Отношение наклонов ликвидуса и солидуса оказывается равным коэффициенту сегрегации
 . (2.2)
. (2.2)
2.4. Задачи
1. Свинцово-оловянный припой имеет весовую концентрацию свинца 70% при 300 оС. Определите концентрацию жидкой и твердой фаз при 200 оС. Найдите при той же температуре массы жидкости и твердого тела, если общая масса равна 5 г.
2. Раствор Pb – Sn с весовой концентрацией Pb 80% остывает от 300 до 150 оС.
а) Опишите процесс остывания подробно.
б) Найдите массы жидкой и твердой фаз, если общая масса равна 25 г.
3. Нарисуйте эвтектическую фазовую диаграмму состояний. Обозначьте все фазы и линии раздела. Подробно опишите, каким образом отвердения расплава приводит к трем различным концентрациям (эвтектическую точку следует рассматривать, а нулевую или стопроцентную концентрацию – нет).
4. Какова максимальная растворимость Si в Al? При какой температуре она достигается?
5. Какова минимальная температура пайка, необходимая для установки кристалла кремния на золотую подложку? Какова при этой оптимальной температуре концентрация Si в Al?
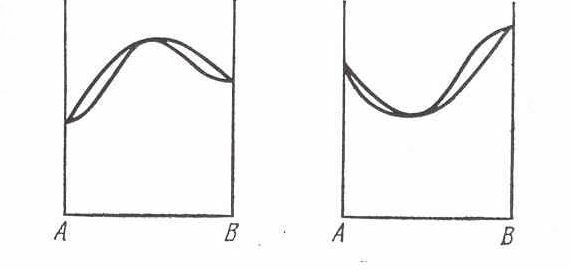
Рис. 2.13. Диаграмма состояния непрерывных
твердых растворов с максимумом или минимумом

Рис. 2.14. Важнейшие типы диаграмм состояния в бинарных системах
Диаграммы плавкости непрерывных твердых растворов могут иметь максимум или минимум (рис. 2.13). Причины возникновения того или иного вида диаграмм состояния рассмотрены на рис. 2.14. На рис. 2.14 приведены важные типы диаграмм состояния по В.А. Немилову.
О диаграммах состояния тройных систем. В случае тройных систем A – B – C можно пользоваться треугольными диаграммами Гиббса (рис. 2.15). Для определения точки Ф опускают перпендикуляры на стороны диаграммы (рис. 2.15, а). Высота перпендикуляра в долях высоты треугольника показывает концентрацию компонента, символ которого помещен в вершине треугольника. Значение свойства задается двумя способами: 1) высотой перпендикуляра (например, Е0Е5 на рис. 2.15, b) к данной точке; 2) кривыми, отражающими на диаграмме геометрические места точек с равными свойствами (так, например, на географической карте изображаются изогипсы). На рис. 2.15, с показана диаграмма плавкости системы Bi – Pb – Sn.
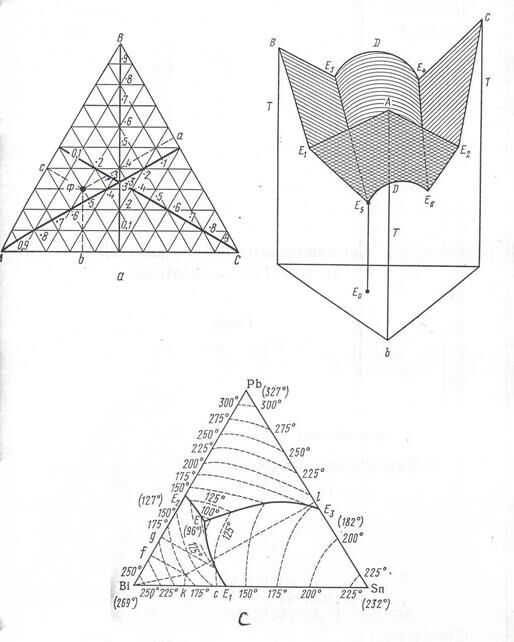
Рис. 2.15. Симметричная тройная диаграмма состояния по Гиббсу:
а – нахождение фигуральной точки;
b – диаграмма состояния в трех измерениях с построением поверхности свойства;
с – диаграмма плавкости для системы Bi – Pb – Sn с нанесенными на ней изотермами и эвтектическими линиями
На рис. 2.15, b компоненты B и C образуют дистектическую диаграмму с эвтектиками Е3 и Е4. Компоненты А и В, а также А и С образуют эвтектические диаграммы с эвтектиками Е1 и Е2 и, наконец, возникают тройные эвтектики Е5 и Е6. В случае, когда компоненты диаграммы А – В – С простые соединения, несимметричная диаграмма (рис. 2.16) никаких преимуществ перед симметричной не имеет. Но если это сложные соединения, то введение несимметричной диаграммы дат существенное преимущества.
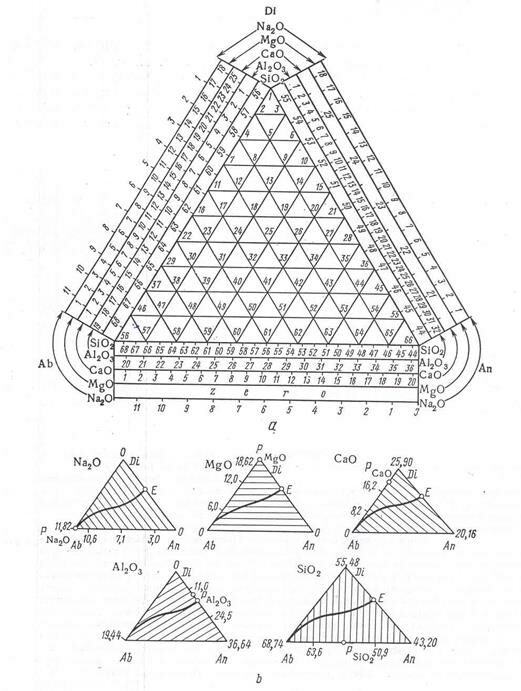
Рис. 2.16. Несимметричная тройная диаграмма состояния для системы альбит – анортит – диопсид. На сторонах диаграммы отложено содержание каждого простого оксида в процентах:
a – общий вид диаграммы;
b – эквиконцентрационные линии на пяти простых оксидов.
Поясним сказанное на примере системы альбит – анортит – диопсид (соответственно Ab – An – Di, на рис. 2.16). Состав альбита:  ; анортита:
; анортита:  ; диопсида:
; диопсида:  . Таким образом, система слагается из пяти оксидов: Na2O, MgO, CaO, Al2O3, и SiO2. Химический анализ содержание именно простых оксидов, а не сложных соединений – компонентов тройной диаграммы. Поэтому, определив химический состав, приходится делать сложные пересчеты для нахождения фигуральной точки. Положение значительно упрощается с использованием метода несимметричной диаграммы по Ормонту (рис. 2.16, а).
. Таким образом, система слагается из пяти оксидов: Na2O, MgO, CaO, Al2O3, и SiO2. Химический анализ содержание именно простых оксидов, а не сложных соединений – компонентов тройной диаграммы. Поэтому, определив химический состав, приходится делать сложные пересчеты для нахождения фигуральной точки. Положение значительно упрощается с использованием метода несимметричной диаграммы по Ормонту (рис. 2.16, а).
Математический анализ показал, что концентрация любого простого оксида может быть представлена эквиконцентрационными углами к сторонам диаграммы (рис. 2.16, а). Отложив на сторонах последней концентрационный масштаб и используя шаблоны, стороны которых направлены под углами, отвечающими эквиконцентрационным линиям (рис. 2.17, а), можно без всякого расчета найти по положению точки ее состав в простых оксидах. Напротив, по химическому составу можно немедленно найти фигуральную точку (рис. 2.17, b). Для этой цели нужно, оказывается, знать содержание не всех (в нашем примере пять), а только некоторых (двух, для надежности трех) простых оксидов, ибо в идеальном случае все прямые должны пересечься в точке S. Можно установить надежность химического анализа (также графическим путем) и т.д.
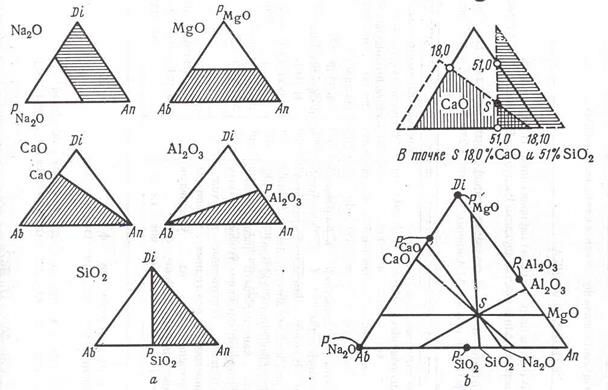
Рис. 2.17. Построение и применение шаблонов для нахождения фигуральной точки по содержанию простых веществ и определение содержания простых веществ по положению фигуральной точки:
а – построение шаблонов; b – применение шаблонов для расчетных цепей.
Так как в производстве диэлектриков часто используются сложные составы, применение несимметричной диаграммы может облегчить работу и исследователя, и технолога. Возникает возможность непосредственно связать химический и фазовый состав с ходом температур плавления, механических, оптических, электрических и магнитных свойств фигуральных точек, значительно сократить количество аналитических определений.
2.5. Фазовые переходы
Переходы из одного фазового состояния в другое при изменении параметров системы.
Фазовые переходы первого рода (испарение, конденсация, плавление, кристаллизация, переходы из одной кристаллической модификации в другую).
Напомним, что кристаллическое состояние веществ классифицируется по семи сингониям (триклинная, моноклинная, ромбическая, тетрагональная, тригональная или ромб…., гексагональная, кубическая) при этом расположение атомов в этих сингониях характеризуется 14 типами решеток (решетки Браве). Степень упаковки атомов в этих решетках различна:
| Простая кубическая | f = 0,52 |
| Объемно центрировая кубическая | f = 0,68 |
| Гранецентрированная кубическая | f = 0,74 |
| Гексагональная плотная упаковка | f = 0,74 |
Из этих данных следует очень важный вывод, при полиморфных превращениях (изменение типа кристаллической решетки) происходит изменение объема и следовательно физико-химических свойств материалов.
При переходах первого рода в точке перехода сосуществует две фазы. Aa -> Bb
а) переход осуществляется при определенной температуре Tпер
б) при переходе изменяются скачком первые производные энергии: энтальпии, энтропии, объема (следовательно значит и плотности)
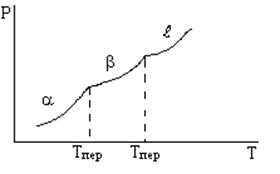
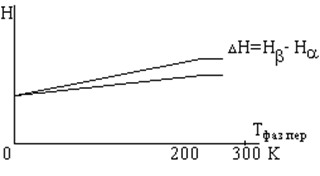
Фазовые переходы второго рода.
При переходах второго рода первые производные свободной энергии, энтальпии, энтропии, объема, плотности изменяются монотонно.
Титанат бария – кубическая структура –> тетрагональный типичный пьезоэлектрик.
MnO – антиферромагнетик при 117 К переходит в парамагнитную фазу.
1. Согласно классификации фазовых превращений, предложенной в 1933 г. Эрипреситом, превращения подразделяются на превращения (переходы) I и II родов.
Переходы первого рода характеризуются тем, что первые производные термодинамического потенциала m по температуре и давлению изменяются скачкообразно

 ,
,
здесь S – энтропия, V – объем
Так как термодинамический потенциал при фазовых переходе меняется непрерывно определяется выражением
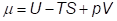
то энергия U также должна изменяться скачком. Так как  , то теплота перехода
, то теплота перехода
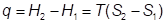
равна произведению температуры на разность энтропии фаз, т. е. скачкообразное изменение или поглощение теплоты.
Важным является непрерывное изменение термодинамического потенциала. Функция  (Т) и
(Т) и  (Т) не изменяют особенностей вблизи точки фазового перехода, при этом с обеих сторон точки фазового перехода имеются минимумы термодинамического потенциала.
(Т) не изменяют особенностей вблизи точки фазового перехода, при этом с обеих сторон точки фазового перехода имеются минимумы термодинамического потенциала.
Этой особенностью объясняется возможность перегрева или переохлаждения фаз в случае фазовых переходов в системе.
Определим взаимосвязи между скачками термодинамических функций  и
и  . После дифференцировании по температуре соотношение Функция
. После дифференцировании по температуре соотношение Функция  (Р,Т) =
(Р,Т) = (Р,Т) с учетом выражения для S, V и q получим
(Р,Т) с учетом выражения для S, V и q получим
 .
.
Эта известная формула Клайперона-Клаузиса. Она позволяет определить изменение давлений, находящихся в равновесии фаз при изменении температуры либо изменении температуры перехода между двумя фазами при изменении давления. Скачкообразное изменение объема приводит к отсутствию определенной связи между структурой и системой фаз, преобразующихся при фазовом переходе первого рода, которые в связи с этим изменяются скачком.
Типичными для фазовых переходов первого рода являются переходы между агрегатными состояниями вещества, аллотропическими превращения многие фазовые превращения в многокомпонентных материалах.
Принципиальное отличие фазовых переходов второго рода от фазовых переходов первого рода заключается в следующем: переходы второго рода характеризуются как непрерывностью изменения термодинамического потенциала, так и непрерывностью изменения производных термодинамического потенциала  .
.
Химическое равновесие
Термодинамическая функция – функция состояния, определяющая изменение термодинамических потенциалов при изменении числа частиц в системе. Другими словами  – есть функция, которая определяет направление и предел самопроизвольного перехода компонента из одной фазы в другую при соответствующих превращениях и условиях (T, P, V, S, ni).
– есть функция, которая определяет направление и предел самопроизвольного перехода компонента из одной фазы в другую при соответствующих превращениях и условиях (T, P, V, S, ni).
Термодинамические потенциалы связаны с друг другом следующими соотношениями
F = U – TS
H = U + pV
G = F + pV
 - количество вещества в граммах;
- количество вещества в граммах;  - количества вещества в молях;
- количества вещества в молях;
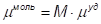
М – молекулярный вес соответствующего вещества.
Для теории твердых растворов, на которых работают все приборы микроэлектроники огромное значение имеет развитый Гиббсом метод химических потенциалов. Химическое равновесие можно определить с помощью химических потенциалов.
Химический потенциал характеризуется энергией, приходящейся на 1 атом
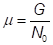
 - химический потенциал; G – энергия Гиббса;
- химический потенциал; G – энергия Гиббса;
No – число Авогадро, NА – L =  моль-1
моль-1
т. е.  (Р,Т) =
(Р,Т) = (Р,Т)
(Р,Т)
Обе кривые характеризуют монотонное убывание  с температурой, определяя значение энтропии фаз
с температурой, определяя значение энтропии фаз
 и
и  .
.
2.6. Термодинамические диаграммы
Функцией состояния называется такая физическая характеристика системы, изменение которой при переходе системы из одного состояния в другое не зависит от вида соответствующего этому переходу термодинамического процесса, а целиком определяется значениями параметров начального и конечного состояний.
Важнейшие функции состояний:
1. Внутренняя энергия E. Внутренней энергией E называется энергия системы, зависящая только от её термодинамического состояния
 ,
,
 – полная энергия системы;
– полная энергия системы;
 – кинетическая энергия макроскопического движения системы;
– кинетическая энергия макроскопического движения системы;
 – потенциальная энергия, связанная с действием на систему внешних силовых полей.
– потенциальная энергия, связанная с действием на систему внешних силовых полей.
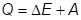
Первый закон термодинамики.
Количество теплоты, сообщенное системе, расходуется на изменение её внутренней энергии и на совершение системой работы против внешних сил.
Второй закон термодинамики:
a) невозможен процесс, единственным результатом которого является совершение работы, эквивалентной количеству теплоты, полученной от нагревателя;
b) невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от холодного тела к горячему.
Для изолированной системы, находящейся в равновесии, энтропия должна быть минимальной
 .
.
Для неизолированной системы при постоянной температуре (изотермический процесс)
 .
.
Напомним, что
Свободная энергия Гельмгольца (F)
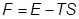
 – свободная энергия, изохорно-изотермический потенциал.
– свободная энергия, изохорно-изотермический потенциал.
Свободная энергия Гиббса
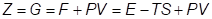
 – термодинамический потенциал, изобарно-изотермический потенциал.
– термодинамический потенциал, изобарно-изотермический потенциал.
Следствие.
При постоянных температуре и давлении свободная энергия Гиббса системы, находящейся в равновесии будет минимальной, а при отклонениях от равновесия
 .
.
2. Энтальпия H (теплосодержание, тепловая функция) – это функция состояния термодинамической системы, равная сумме её внутренней энергии и произведения давления на объём системы
 .
.
3. Энтропия S. Энтропией называется функция S состояния системы, дифференциал которой в элементарном обратном процессе равен отношению бесконечно малого количества теплоты, сообщённого системе, к абсолютной температуре системы:
 .
.
4. Изобарно-изотерический потенциал G. Характеристической функцией и термодинамическим потенциалом является функция состояния системы
 .
.
Это изобарно-изотермический потенциал (изобарный потенциал, термодинамический потенциал Гиббса).
5. Изохорно-изотермический потенциал
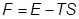
Функция Гельмгольца (изохорный потенциал, свободная энергия)
2.6.1. Диаграмма состояния (диаграмма равновесия, фазовая диаграмма)
Любая термодинамическая система может в зависимости от условий находится в 4-х агрегатных состояниях: плазма, газ, жидкость, твёрдое тело.
Геометрическое изображение равновесных состояний термодинамической системы при различных значениях параметров (T, p, xi – концентрации компонентов, мольного объёма V и др.) называется диаграммой состояния.
Диаграмма состояния даёт информацию о фазовом составе системы в зависимости от параметров
 O – равновесие трёх фаз, тройная точка;
O – равновесие трёх фаз, тройная точка;
OA – кривая возгонки или сублимации;
OK – кривая испарения;
OB – кривая плавления;
A, K, B – критические точки, в точке K исчезает различие G – L, в B – L – S, в A – S – G.
Полиморфные превращения (алмаз – графит) усложняют диаграмму состояния. У SiO2 – 11 полиморфных превращений в технологическом варианте синтеза изделий микроэлектроники, при этом изменяется не только тип кристаллической решётки, но и мольный объём V.
2.6.2. Растворимость
Концентрация вакансий от 1 до 1023. 1023 – число атомов в единице объёма.
S – энтропия, увеличивается значительно.
При равновесии 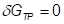
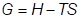
В результате можно показать, что число вакансий увеличивается с температурой.
Равновесные состояния физически однородной системы и совершаемые ею равновесные процессы можно изображать графически соответственно точками и кривыми на плоскости с прямоугольными декартовыми координатами, вдоль осей которых откладываются параметры состояния системы, или однозначно связанные с ними функции состояния. Наиболее распространённые диаграммы V – P, S – T, S – H (первый символ – ось абсцисс, второй – ось ординат).
2.6.3. Международная система единиц СИ (метр, килограмм, секунда, градус, Кельвин, моль)
Кельвин, К, единица термодинамической температуры, 1/273,16 – части термодинамической температуры тройной точки воды.
Моль – единица количества вещества, равная количеству вещества системы, в которой содержится столько структурных элементов (молекул, атомов, ионов, электронов, других частиц или специфицированных групп частиц), сколько атомов содержится в 0,012 кг нуклида 12C (изотопа углерода с атомной массой 12).
Прежде, чем перейти к рассмотрению диаграмм состояния вспомним некоторые определения. (У каждой науки свой язык, …)
Фаза – в термодинамике, не путать с радиотехникой, совокупность частей системы, тождественных по химическому составу и термодинамическим свойствам и находящихся между собой в термодинамическом равновесии.
Гомогенная система однофазна, в ней отсутствуют внутренние границы раздела.
Гетерогенная система содержит как минимум две фазы. Вода в тройной точке содержит три фазы: лед, жидкость, пар. Фаза отделена друг от друга поверхностями раздела. Вещество может существовать в виде различных фаз (напр. агрегатных состояний, полиморфных модификаций).
В отсутствии внешних полей и химических реакций состояние фазы, содержащей k – компонентов, определяется k+1 независимыми переменными (температура, давление) и (k-1) мольными долями компонентов.
В общем виде правило фаз определяется соотношением
 ,
,
где  - число компонентов;
- число компонентов;
 - число фаз;
- число фаз;
 - число параметров, определяющих равновесие;
- число параметров, определяющих равновесие;
 - число степеней свободы, т.е. число независимых способов, которыми можно изменить состояние системы, при изменении параметров системы.
- число степеней свободы, т.е. число независимых способов, которыми можно изменить состояние системы, при изменении параметров системы.
Иногда используется для определения  термин вариантность системы.
термин вариантность системы.
Обычно состояние системы определяется двумя параметрами T и P. В этом случае правило фаз определяется соотношением Гиббса.
 ,
,
при  - нонвариантная (инвариантная система (
- нонвариантная (инвариантная система ( );
);
 и
и  - моновариантная система;
- моновариантная система;
 и
и  - дивариантная система.
- дивариантная система.
Многие вещества при постоянном давлении имеют определенную температуру плавления. При этом жидкая и твердая фаза таких веществ в определенном температурном интервале будут находиться в равновесии.
Для двойных сплавов (A, B) свободная энергия на 1 моль фазы при P=const, полностью определяется температурой системы и ее составом. Зависимость молярной свободной энергии от состава можно изобразить графически.
Для жидкой фазы значение свободной энергии ниже, чем для твердой фазы при температуре T, независимо от соотношения компонентов A, B.
Если система состоит из твердой или жидкой фазы состава NB(2) свободная энергия системы может быть понижена превращением системы в твердую фазу состава NB(1) или жидкую фазу состава NВ(3).
Значение свободной энергии смесей состава NB(1) и NB(3) должно лежать на пунктирной линии, зависимости G от NB.
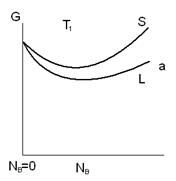
Рис . Зависимость молярной свободной энергии жидкой и твердой фаз от атомной доли компонента B(NB) для температуры T1(а).
 Диаграмма состояния (б).
Диаграмма состояния (б).
Диаграмма состояния показывает, что при температуре выше T1 сплавы всех составов будут представлять собой равновесную жидкую фазу. Сплав NВ(3) до температуры T2 находится только в жидком состоянии, после T3 – только в твердом состоянии. В промежутке от T2 до T3 в обоих (жидкость + твердое тело) фазах.
Зависимость молярной свободной энергии жидкой и твердой фаз от атомной доли компонента B(NB) для температуры T2(в).
2.6.4. Метод построения диаграмм состояния
Твердые растворы двойных сплавов AB могут иметь в зависимости от концентрации разные кристаллические решетки, т.е. разные фазы. AB – гексагональная, A3B – кубическая и т. д.
Термодинамический потенциал
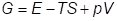
 , тогда
, тогда
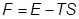 .
.
 - свободная энергия Гельмгольца.
- свободная энергия Гельмгольца.
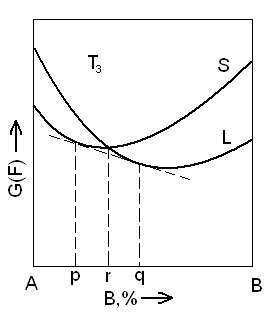
То же. Показано равновесие жидкой и твердой фаз при температуре T3
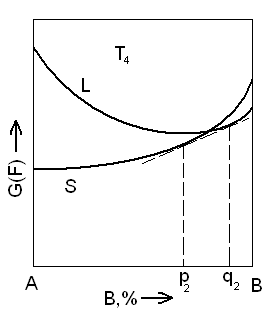
Кривые свободной энергии для жидких и твердых растворов в системе с неограниченной растворимостью компонентов в жидком и твердом состоянии. Показано равновесие жидкой и твердой фаз при температуре T4.
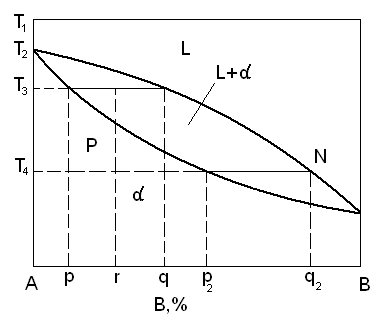
Равновесная диаграмма состояния, соответствующая кривым свободной энергии при температуре T1, T2, T3, T4…
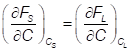
Составы твердой и жидкой фаз находящихся в равновесии друг с другом, определяются точками касания общей касательной к обеим кривым свободной энергии. Условие равновесия имеет вид в точке X
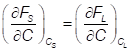
T2 – температура, при которой кристаллизуется или плавится компонент A;
Tn – температура, при которой кристаллизуется или плавится компонент B.
При этих температурах соответственно для A и B твердая и жидкая фаза имеют одну и ту же свободную энергию.
Состав твердой и жидкой фаз, находящихся в равновесии друг с другом при различных температурах, можно нанести на диаграмму в координатах температура – состав. При таком построении получается фазовая, или равновесная, диаграмма состояния, которая обобщает все сведения, вытекающие из проведенного анализа кривых свободной энергии.
При температурах выше кривой MNO, называемой кривой ликвидуса, сплавы различного состава находятся в жидком состоянии.
При температурах ниже кривой MPO, называемой кривой солидуса, все сплавы находятся в твердом состоянии и представляют собой твердые растворы.
В области MNOP система представляет собой смесь жидкой и твердой фаз, находящимся в равновесии друг с другом.
В области MNOP – система характеризуется одной термодинамической степенью свободы. Области MNO и MPO система характеризуется двумя термодинамическими степенями свободы.
2.6.5. Системы с ограниченной взаимной растворимостью компонентов в твердом состоянии
A и B имеют различную кристаллическую структуру. Они неограниченно растворяются друг в друге в жидком состоянии и ограничено в твердом.
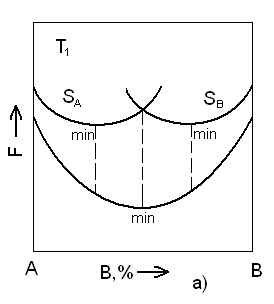
Кривые свободной энергии при температуре T1 для систем с ограниченной растворимостью компонентов в твердом состоянии
а – минимум для кривой свободной энергии жидкой фазы находится между минимумами свободной энергии для твердых фаз A и B.
б – интервалы для минимумов свободной энергии в твердом и жидком состояниях не совпадают.
В результате построения свободных энергий для различных температур для случая а получим
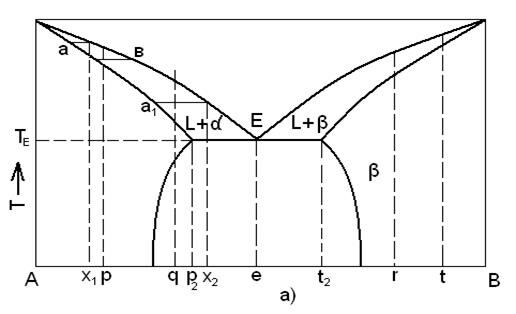
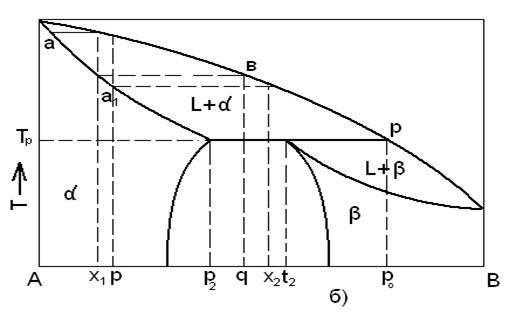
Равновесная диаграмма состояния с ограниченной растворимостью компонентов в твердом состоянии:
а – система эвтектического типа;
б – система перитектического типа.
Вам также может быть полезна лекция "11 Тестовые задания".
Сплав состава точки E называют эвтектическим. Жидкость этого состава кристаллизуется при эвтектической температуре TE, образуя смесь кристаллов двух твердых растворов составов p2t2.
Отношение весовых количеств этих твердых фаз измеряется отношением отрезков  .
.
Для диаграмм второго типа, где минимум для свободной энергии жидкой фазы находится за пределами интервала для минимумов свободной энергии для твердых фаз. Имеется особая температура Tp, при которой в равновесии находятся три фазы: жидкая, состава p0 и твердые растворы α- и β-состава p2 и t2 соответственно.
Система состоящая из трех фаз, находящихся в равновесии друг с другом, не имеет степеней свободы, т. е. является нонвариантной.
Точку p называют перитектикой. Значение этой диаграммы состояния заключается в том, что при температуре Tp жидкость состава p0 реагирует с кристаллами α-твердого раствора состава p2, в результате чего образуются кристаллы β-твердого раствора состава t2.
В равновесных условиях температура остается постоянной и равной Tp до тех пор, пока не закончится перитектическая реакция; такая система является нонвариантной (три фазы находятся в равновесии и нет степеней свободы).





















