Механизм бактериального окисления и выщелачивания сульфидных минералов
ЛЕКЦИЯ 10. Механизм бактериального окисления и выщелачивания сульфидных минералов
План:
1. Общие понятия о механизме бактериального окисления сульфидных минералов.
2. Схематическая модель механизма бактериального окисления арсенопирита.
3. Схема механизма бактериального окисления пирита и арсенопирита.
Цель занятий:
Дать студентам понятия о механизме бактериального окисления и выщелачивания сульфидных минералов.
Опорные слова:
клетка, поверхность, кислород, система, окисления, разращения, сера, ферментативный, электрохимический, деструкция, биоэлек-трокатализ.
1. Механизм бактериального окисления и выщелачивания сульфидных минералов можно представить на примере арсенопирита следующим образом с учетом кинетики процесса и особенностей биохимического окисления железа и серы.
Рекомендуемые материалы
Бактериальные клетки сорбируются и прочно закрепляются на поверхности арсенопирита. Под действием химических агентов кислорода и трехвалентного железа, а также биологических агентов ферментативных систем бактерий элементы кристаллической решетки минерала - железо и сера - подвергаются окислению, при этом поверхность минерала разрушается и компоненты кристаллической решетки выщелачивается. Двухвалентное железо, образующееся при этом, входит в состав активного центра фермента, как связующее звено между минералом и ферментом, находясь с обоими в соединении и удерживая субстрат около активного центра фермента. Последующий распад этого комплекса дает конечный продукт окисления - трехвалентное железо. Подобному бактериальному окислению подвергается сульфидная сера, конечным продуктом ферментативного окисления которой является сульфат-ион.
В соответствии с реакцией:
FeAsS → Fe2++ As3+ + S0 + 7e
при электрохимическом процессе на поверхности арсенопирита образуется закисное железо, элементная сера и мышьяковистая кислота:
FeAsS + Fe2(SO4)3 +1,5 H2O + 0,75 O2 = 3 FeSO4 + S0 + 7e
На поверхности арсенопирита железо и сера подвергаются биокаталитическому окислению до соединений высшей степени окисления.. Элементная сера под действием серусодержащих ферментов переходит в -модификацию и окисляется до сульфат - ионов.
S0 + 4 H2O → SO42- + 8 H+ + 6 ē
ē
или S0 + H2O + 1,5 O2 = H2SO4 (1)
Двухвалентное железо, которое образуется при деструкции кристаллической решетки минерала за счет восстановления трехвалентного железа арсенопирита с принятием электронов от серы и мышьяка, окисляется микроорганизмами до трехвалентного в диффузионном слое минерала и при выходе его из минерала в объеме раствора:
2 FeSO4 + 0,5 O2 + H2SO4 → Fe2(SO4)3 + H2O. (2)
Окисное железо при этом частично переходит в раствор и остается в диффузионном слое минерала, что обеспечивает его быстрое взаимодействие с сульфидной поверхностью.
Мышьяк в растворе присутствует в виде мышьяковистой кислоты, т.к. он может существовать в виде катиона только в сильнокислых растворах:
As3+ + 3 H2O = AsO33- + 6 H+ = H3AsO3 + 3 H+ Мышьяковистая кислота, в свою очередь, окисляется до мышьяковой кислородом:
H3AsO3 + 0,5 O2 → H3AsO4. При наличии в растворе окисного железа образуется арсенат:
Fe3+ + H2AsO4- → FeAsO4 + 2 H+.
Таким образом, конечными продуктами бактериального окисления и выщелачивания арсенопирита являются арсенат железа и серная кислота:
FeAsS + 3,5 O2 + H2O → FeAsO4 + H2SO4. (3)
2. Схематическая модель механизма бактериального окисления арсенопирита представлена на рис.1, где показана тесная связь процессов биологического характера и связанных с ними электрохимических процессов на поверхности арсенопирита и в объеме жидкой фазы. Поэтому ускорение ферментативными системами бактерий электрохимических реакций окисления сульфидных минералов можно назвать биоэлектрокатализом.
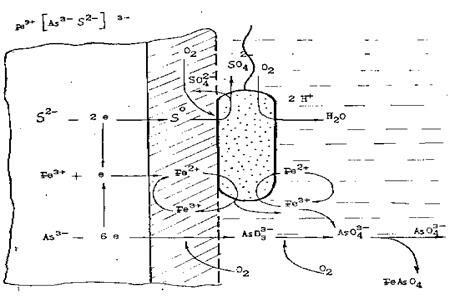
Рис.10.1. Схематическая модель процесса бактериального окисления
и выщелачивания арсенопирита
Подобный механизм бактериального окисления и выщелачивания сульфидных минералов характерен и для других минералов, как содержащих в своей структуре железо, так и не имеющих его.
Общими при бактериальном окислении сульфидных минера-лов, содержащих железо, будут реакции 4 и 5, остальные реакции окисления
- для пирита:
2 FeS2 + 7 O2 + 2 H2O →2 Fe2+ + 4 SO2-4 + 4 H;+
FeS2 + 14 Fe3++ 8 H2O →15 Fe2++ 2 SO42-+ 16 H;+
для халькопирита:
2 CuFeS2+ 8,5 O2+ 2 H+ → Cu2++ 2 Fe3++ 4 SO42++ H2O; CuFeS2 + 4 Fe3+ → Cu2++ 5 Fe2++ 2 S0;
для пирротина:
2 FeS + 4,5 O2+ 2 H+ →2 Fe3++ 2 SO42-+ H2O;
2 FeS + 1,5 O2+ 6 H+ →2 Fe3++ 2 S0 + 3H2O;
FeS + 8 Fe3++ 4 H2O → 9 Fe2++ SO42-+ 8 H+; -для сульфидов, не содержащих железа, например, сфалерита:
ZnS + 2,5 O2 + 2 H+ →Zn2++ SO42-+ H2O; (4) ZnS = Zn2-+ S0 + 2ē;
Однако в рассматриваемом механизме не учитывается один немаловажный фактор - наличие в выщелачиваемом материале нескольких сульфидных минералов, которые отличаются своими электрохимическими характеристиками, а, следовательно, находясь в пульпе в присутствии бактерий, оказывают взаимное влияние на окисление и выщелачивание друг друга.
Рассмотрим механизм электрохимических реакций при бактериальном выщелачивании смеси минералов - арсенопирита и пирита.
Катодная реакция гальванического взаимодействия арсенопирита и пирита ( φ=0,45 В) может осуществляться тремя различными путями:
- деполяризация пирита кислородом
O2 + 4 H+ + 4e → 2 H2O; (5) деполяризация пирита окисным железом
Fe3+ + e → Fe2+ ; Смешанная деполяризация кислородом и окисным железом
O2 +Fe3+ + 4 H+ + 5e →Fe2+ + 2 H2O. (6) Эти катодные реакции дополняются анодной
FeAsS + 3 H2O → Fe2+ + AsO33- + 6 H+ + S0 +5e; (7)
Сумма реакций (5) и (7)
4 FeAsS + 2 H2O +5 O2 +4 H2SO4 → 4 FeSO4 + 4 H3AsO3 + 4 S0
представляет собой механизм окисления арсенопирита при непосредственном взаимодействии его с бактериями и кислородом, т.е. “прямой” механизм.
Сумма реакций (6) и (7)
2 FeAsS+2O2+Fe2(SO4)3+H2SO4+2H2O → 4FeSO4+2S0+2H3AsO3
представляет собой механизм окисления арсенопирита оксидным железом при участии бактерий, т.е. “косвенный” механизм.
При деполяризации пирита в условиях бактериального выщелачивания основным деполяризатором является оксидное железо. Скорость реакции, проходящей при участии кислорода в 500-600 раз меньше скорости, обусловленной наличием оксидного железа, которого в 20-25 тысяч раз больше концентрации кислорода. Поэтому по катодной (4) и анодной (5) реакциям основная роль при окислении арсенопирита принадлежит Fe3+.
2FeAsS+5Fe2(SO4)3+6H2O →12FeSO4+2S0+2H3AsO3+3H2SO4 (8)
Помимо реакции (8) протекают реакции:
4 FeSO4 + O2 + 2 H2SO4 → 2 Fe2(SO4)3 + 2 H2O
2 S0 + 3 O2 +2 H2O → 2 H2SO4
3 H3AsO3 + 2 Fe2(SO4)3 + 2 H2O → 4 FeSO4 + 2 H2SO4 + 2 H3AsO4
Fe2(SO4)3 + H3AsO4 → 2 FeAsO4 ↓ + 3 H2SO4 итоговая реакция
2 FeAsS + 7 O2 + 2 H2O → 2 FeAsO4 + 2 H2SO4 аналогично реакции (3).
3. Схема механизма бактериального окисления арсенопирита в присутствии пирита и микроорганизмов представлена на рис.10. 2.
а)
б)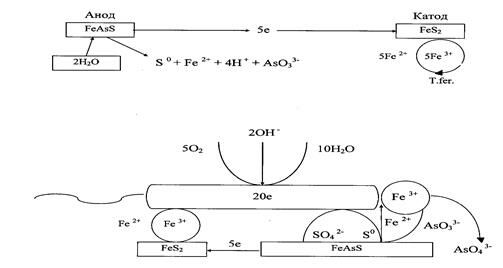
Рис.10. 2. Схема механизма бактериального окисления пирита и арсенопирита, представленного в виде катодно – анодной реакции (а) и в присутствии клетки (б)
При рН 2,0-1,2, ОВП жидкой фазы 0,78-0,84 В и концентрации железа 7…15 г/л, арсенопирит термодинамический неустойчив и деструктирует через промежуточные фазы реальгара и аурипигмента с образованием закисного железа, о-мышьяковистой кислоты и элементной серы. Арсенопирит заряжается отрицательно, координируя вокруг себя положительно заряженную сферу.
Пирит является первичным акцептором электронов. Ионы оксидного железа (0,5-1 моль/л) восстанавливаются на пирите до закисного, который выполняет функцию вторичного акцептора электронов. При этом анодная и катодная реакции делокализованы в пространстве. Образующееся закисное железо окисляется бактериями до окисного. Конечным акцептором электронов является кислород. Окисление закисного железа осуществляется бактериями, как находящимися в растворе, так и иммобилизованными на минерале. Окисление элементной серы бактериями происходит в основном на поверхности минерала. Таким образом, бактерии катализируют процессы окисления элементов кристаллической решетки (Fe2+ и S2-), т.е. служат переносчиками электронов к их конечному акцептору кислороду через цепь промежуточных акцепторов - пирит и оксидное железо.
Вопросы для повторения:
1. Как вы представляете механизм бактериального окисления и выщелачивания сульфидных минералов (например, арсенопирита )?
2. Напишите реакции конечного продукта бактериального окисления и выщелачивания арсенопирита?
3.Опишите схематическую модель процесса бактериального окис-ления и выщелачивания арсенопирита?
4.Охарактеризуйте процесс бактериального окисления при наличии в выщелачиваемом материале нескольких сульфидных минералов?
5. Опишите схему механизма бактериального окисления пирита и арсенопирита?

Предмет: «Биотехнологические процессы в металлургии»
Преподаватель: доц. Абдурахманов Э.
Количество студентов и курс: 48 студентов, 4 курс
Продолжительность занятия: 80 минут
| Тема: 10 | Механизм бактериального окисления и выщелачивания сульфидных минералов |
| Цель, задачи | Цель: Дать студентам понятия о механизме бактериального окисления и выщелачивания сульфидных минералов. Задачи: - - Развить интерес студентов к данной теме, формирование знаний и навыков по теме и их расширение. - - Контроль степени освоения темы с помощью групповой полемики и полемики каждого участника группы, дискуссии на основании, «Смысл понятие» оценка их знаний. |
| Содержание учебного процесса | Общие понятия о механизме бактериального окисления сульфидных минералов. Схематическая модель механизма бактериального окисления арсенопирита. Схема механизма бактериального окисления пирита и арсенопирита. |
| Применяемая в учебном процессе технология. | Метод: Устное обсуждение, технология “Знакомство”, “Смысл понятие”. Форма: Лекция - дискуссия, работа среди групп и с каждым участником. Средство: Устное общение и дискуссия применительно к практике Контроль: Устный контроль, вопрос-ответ, наблюдение, самостоятельный котнроль друг за другом. Оценка: Стимуляция интереса, рейтинговая оценка на основании технологии “Блиц-опрос”. |
| Ожидаемые результаты | Преподаватель: Стимулирует интерес студентов к данной теме, повышает активность студентов. Увеличиваеи заинтересованность присутствующих на занятии студентов. Производится оценка знаний всех студентов на занятии. Достигают целей, поставленных самими себе. Достигается развитие таких свойств характера, как независимая работа, творческое мышление, обсуждение идей. Студент: Освоение новых знаний. Укрепляет теоретические знания. Изучает работу в группах и одиночно. Развивает авторитетность и способность демонстрировать. Развивает самостоятельный контроль. |
| Планы на будущее (анализ, изменения) | Преподаватель: Примененение и совершенствование подходящих к теме учебного занятия новых педагогических технологий. Работа над собой. Проработка темы, а также применение опыта зарубежных стран на основании сведений из Интернета. Увеличение педагогического мастерства. Студент: Формирование навыков самостоятельной работы, своевременное и правильное использование сведений из Интернета. Укрепление своих способностей и таланта в достаточно полной мере при творческом подходе к теме. |
Технология «Смысл понятие»
| ПОНЯТИЕ | СМЫСЛ |
| Рекомендуем посмотреть лекцию "4. Структура ИС". клетка | |
| поверхность | |
| кислород | |
| биоэлек-трокатализ | |
| ферментативный | |
| деструкция |























