Гальванический элемент Якоби-Даниэля. ЭДС
7.3. Гальванический элемент Якоби-Даниэля. ЭДС
Превращение химической энергии в электрическую происходит в электрохимических системах, которые называются гальваническими элементами.
Гальванический элемент представляет собой замкнутую электрохимическую систему, состоящую из двух электродов.
Рассмотрим гальванический элемент Якоби-Даниэля. Он состоит из медной пластины, погруженной в раствор CuSC4, и цинковой пластины, погруженной в раствор ZnSC4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
Схема гальванического элемента:
Zn | ZnSO4| | CuSO4| Cu,
Zn | Zn2+ | | Cu2+ | Cu.
На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие:
Zn-2e « Zn2+.
Рекомендуемые материалы
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие:
Сu2+ + 2е « Сu, поэтому возникает электродный потенциал меди.
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т. е. при соединении цинка с медью метал лическим проводником, электроны будут переходить от цинка к меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или не высадится на медном электроде вся медь).
Итак, при работе элемента Якоби-Даниэля протекают следующие процессы:
1) реакция окисления цинка: Zn - 2е ® Zn2+.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
2) реакция восстановления ионов меди: Сu2+ + 2е « Сu.
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами;
движение электронов во внешней цепи;
движение ионов в растворе: анионов (SO4-2) к аноду, катионов (Cu2+, Zn2+) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем:
Zn + Cu2+ = Zn2+ + Сu.
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т. е. образуется замкнутая электрическая система и в ней возникает электрический ток. Суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
Электрический ток, возникающий в данной электрохимической системе, численно характеризуется величиной электродвижущей силы (ЭДС) элемента. Она равна разности электродных потенциалов катода и анода:
 (7.3)
(7.3)
В стандартных условиях самопроизвольное протекание химической реакции возможно, когда максимальная полезная работа, совершаемая в результате данной реакции, равна отрицательной величине изменения свободной энергии:
А =-DG0 (7.4)
В гальваническом элементе совершаемая максимальная электрическая работа в стандартных условиях равна ЭДС элемента, умноженной на количество электричества (nF), т. е.
А = nFE0, (7.5)
где n - число электронов, участвующих в реакции;
F- постоянная Фарадея, равная 96500 Кл/моль;
E0 - стандартная ЭДС гальванического элемента (T= 298 К, молярная концентрация электролитов равна 1 моль/дм3). Таким образом, максимальная работа гальванического элемента равна:
А =-DG0= nFE0. (7.6)
Стандартная ЭДС гальванического элемента равна:
 (7.7)
(7.7)
Гальванические элементы в зависимости от природы электродов и концентрации электролитов разделяют на химические и концентрационные.
Химические гальванические элементы - это такие элементы, где электроды и электролиты различны. Примером химического гальванического элемента является элемент Якоби-Даниэля.
Концентрационные гальванические элементы - это такие элементы, которые состоят из одинаковых электродов, но концентрации электролитов различны, например, серебряные электроды, погруженные в растворы нитрата серебра разной концентрации:
Ag | AgNO3 (0,01 моль/дм3) | | AgNO3 (0,1 моль/дм3) | Ag.
Пример 1. Гальванический элемент состоит из металлического цинка, погруженного в раствор нитрата цинка с молярной концентрацией 0,1 моль/дм3, и металлического свинца, погруженного в раствор нитрата свинца с молярной концентрацией 0,02 моль/дм3 Вычислите ЭДС элемента, напишите уравнения электродных процессов, составьте схему элемента.
Решение. Чтобы определить ЭДС элемента, необходимо вычислить электродные потенциалы по уравнению Нернста (7.2):
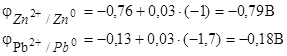
Находим ЭДС элемента по формуле (7.3):
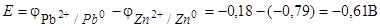
Поскольку  , то на свинцовом электроде будет происходить восстановление, т. е. он будет служить катодом:
, то на свинцовом электроде будет происходить восстановление, т. е. он будет служить катодом:
Рb2+ + 2e = Рb.
36. Оценка результатов труда и вознаграждение в организационном поведении - лекция, которая пользуется популярностью у тех, кто читал эту лекцию.
На цинковом электроде будет протекать процесс окисления:
Zn = Zn2+ + 2e,
т. е. этот электрод будет анодом.
Схема рассматриваемого гальванического элемента имеет следующий вид:
А (-) Zn | Zn(NO3)2 | | Pb(NO3)2 | Pb (+) К.
Ответ: 0,61 В.






















