Примеры равновесий в некоторых технических процессах
Лекция 20
Примеры равновесий в некоторых технических процессах. Влияние давления на равновесие в идеальных газовых смесях.
I. Реакции, протекающие в газовой фазе без изменения числа молекул
Реакции, в результате которых число молекул не меняется, принадлежат к простейшему стехиометрическому типу реакций. К этому типу относятся многие технически важные реакции :
реакция получения водяного газа CO + H2O Û CO2 + H2
синтеза окиси азота N2 + O2 Û 2NO
Одной из первых реакций такого типа, равновесие которой было изучено, является реакция синтеза HJ (Боденштейн) : H2 + J2 Û 2HJ
Рекомендуемые материалы
КР =  =
=  =
= 
( рi =  RT = ci RT ; множители RT/V или RT сокращаются, т.к. число молекул или объем смеси в результате реакции не изменяются); КР = КС = КN (в дальнейшем отбросим индекс у К).
RT = ci RT ; множители RT/V или RT сокращаются, т.к. число молекул или объем смеси в результате реакции не изменяются); КР = КС = КN (в дальнейшем отбросим индекс у К).
Обозначим : а - начальное число молей Н2
b - начальное число молей J2
х - число молей образовавшегося HJ
Тогда числа молей в равновесной смеси будут равны :
nHJ = x ,  = a -
= a - 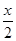 ,
,  = b -
= b - 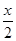
Подставим эти значения в уравнение :
К¢ =  =
= 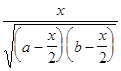
Решение этого уравнения имеет следующий вид :
х = 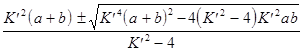
Зная К¢, а, b , можно вычислить х и сравнить с опытными величинами.
Рассмотрим теперь реакцию термической диссоциации HJ, обратную разобранной:
HJ Û  H2 +
H2 +  J2
J2
K¢¢ =  =
= 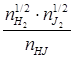
Как и для всякой реакции диссоциации, константа равновесия может быть выражена через степень диссоциации a , являющуюся долей продиссоциировавших молекул от исходного числа молекул no . При равновесии :
nHJ = (1 - a)no ,  =
=  =
= 
K¢¢ =  или К¢ =
или К¢ =  ; a =
; a =  =
= 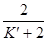
Если в исходной смеси, кроме HJ, находится один из продуктов реакции, то a принимает иное, меньшее значение.
От общего давления степень диссоциации HJ не зависит, и при сжатии равновесной смеси ее состав не изменится.
a и К¢¢ (константа диссоциации) являются количественными характеристиками прочности соединения и у разных веществ они, естественно, различны (при одинаковых условиях).
II. Реакции, протекающие в газовой фазе с изменением числа молекул
- 1 -
Наиболее простыми из таких реакций являются реакции диссоциации одной молекулы на две одинаковые или разные молекулы (или атомы). К ним относятся :
диссоциация молекулярного J2 (Br2, Cl2, N2, O2 ...) : J2 Û J + J
реакции : N2O4 Û 2NO2
PCl5 Û PCl3 + Cl2 и т.д.
Рассмотрим реакцию диссоциации N2O4 (удобна для изучения при Т, близких к комнатной): KP = 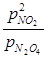
Выразим КР через a - степень диссоциации N2O4. Обозначим : no - исходное число молей N2O4. При равновесии :
 = (1 - a) no ,
= (1 - a) no ,  = 2a no
= 2a no
Общее число молей в смеси ån = no - a no + 2a no = no + a no = (1 + a) no
Тогда парциальные давления будут равны (Р - общее давление) :
 = Р ×
= Р × = Р
= Р  = Р
= Р  = Р
= Р 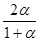
 = Р ×
= Р × = Р
= Р  = Р
= Р 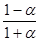
КР =  = Р
= Р 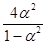
Поскольку КР не зависит от Р (для идеальных газов), то с ростом Р a уменьшается (в соответствии с законом смещения равновесия). Этим реакции, протекающие с изменением числа молекул, отличаются от реакций, рассмотренных ранее. Найдем связь между КР , Кс , КN для этой реакции :
КР = Кс (RT)Dn = Kc RT Dn = 1
KP = KN PDn = KN P
- 2 -
Рассмотрим еще один тип реакций, для которых Dn = 1 :
2CO2 Û 2CO + O2 Выразим через a КР реакций
2SO3 Û 2SO2 + O2 этого типа
2H2O Û 2H2 + O2
-----------------
2 (1 - a) 2a a - числа молей веществ в состоянии равновесия;
no = 2.
ån = 2 - 2a + 2a + a = 2 + a
 = P ×
= P × = P
= P 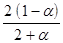
 = P ×
= P × = P
= P  ,
,  = P ×
= P × = P
= P 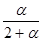
KP =  =
=  = P
= P 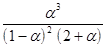
Это кубическое уравнение относительно a . Если a очень мала (для водяного пара это имеет место при Т £ 1500оС), то ею можно пренебречь в скобках в знаменателе:
КР = Р 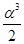
Þ Влияние Р на a незначительно : при увеличении Р в 10 раз a уменьшается в  = 2,15 раза.
= 2,15 раза.
К рассмотренному типу принадлежит важнейшая промышленная реакция контактного получения серного ангидрида :
2SO2 + O2 Û 2SO3
КР = 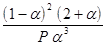
- если в исходной смеси SO2 и О2 находятся в эквивалентных количествах. Т.к. в равновесной смеси количества всех компонентов при практически используемой Т соизмеримы, то составление упрощенного выражения недопустимо.
В общем случае исходные количества SO2 и О2 неэквивалентны, и выражать КР через степень диссоциации SO3 нельзя. КР в данном случае можно выразить с помощью другой, наиболее важной для техники величины - степени превращения b сернистого газа. Степень превращения равна доле исходного количества вещества (в данном случае SO2), вступившего в реакцию. Чем больше b, тем полнее протекает реакция.
Введем обозначения : no - исходное число молей SO2
no× a - исходное число молей О2
b - степень превращения
В равновесии :
 = no (1 - b) ,
= no (1 - b) ,  = no (а -
= no (а -  ) ,
) ,  = no b
= no b
ån = no - no b + no a - no  + no b = no (1 + a -
+ no b = no (1 + a -  )
)
 = P ×
= P × = P
= P 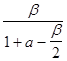
 = P ×
= P × = P
= P  ,
,  = P ×
= P × = P
= P 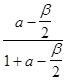
KP =  =
=  =
= 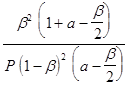
Опытные и вычисленные значения КР практически совпадают.
Видно уменьшение b, т.е. выхода SO3 , по мере уменьшения относительного количества O2. Можно теоретически показать, что максимальный выход всегда получается из стехиометрической смеси, в данном случае 2SO2 + O2 .
- 3 -
К иному стехиометрическому типу относится одна из важнейших реакций неорганического синтеза - синтез NH3 :
 N2 +
N2 +  H2 Û NH3
H2 Û NH3
Информация в лекции "Искусство наслаждаться" поможет Вам.
За протеканием реакции удобно следить, измеряя мольную долю N аммиака в равновесной смеси. Если при синтезе NH3 берется стехиометрическая смесь H2 и N2, то в состоянии равновесия мольные доли компонентов будут составлять :–
 = N ,
= N ,  =
=  (1 - N) ,
(1 - N) ,  =
=  (1 - N)
(1 - N)
КР =  =
=  =
= 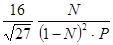
N увеличивается с ростом Р. КР в этом случае также растет с ростом Р; КР ≠ const вследствие увеличивающегося с ростом Р отклонения газовой смеси от идеального состояния. В этих условиях константой является Кf , равная КР при малых Р.
Рассмотрение конкретных примеров газовых равновесий показывает, что вид выражений для Кравн изменяется в зависимости от стехиометрического типа реакции и величины, выбранной для характеристики процесса (α , β , N и т.д.). Выбор последних величин произволен; следует в каждом конкретном случае найти выражение Кравн через любые желательные величины.
Константа КР наиболее удобна для выводов и расчетов. При ее использовании легко учитывается влияние индифферентного газа - компонента газовой реакции. Если общее Р не входит в выражение для КР (случай I), то индифферентный газ не влияет на равновесие; если же число молей меняется в ходе реакции, то прибавление индифферентного газа может изменить выход продуктов реакции.





















