Химическое равновесие в газах и растворах. Закон действия масс
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
(20 час. лекций и 8 час. решения задач)
Лекция 18
Химическое равновесие в газах и растворах. Закон действия масс. Различные формы выражения константы равновесия, связь между ними. Термодинамический вывод константы равновесия.
Направление химической реакции в ряде случаев зависит от давления газа и от концентрации раствора и при известных значениях этих величин реакция может прекратиться, не дойдя до конца. Т.о., химические реакции обратимы : наряду с химическим взаимодействием между исходными веществами (прямая реакция) протекает химическое взаимодействие между продуктами реакции (обратная реакция), в результате которого снова образуются исходные вещества. По мере протекания процесса скорость прямой реакции (количество молекул, прореагировавших за секунду) уменьшается, а скорость обратной реакции увеличивается. Когда обе скорости сравняются, наступает состояние химического равновесия - число молекул веществ, составляющих химическую систему, перестает меняться и остается постоянным во времени при неизменных внешних условиях. Химическое равновесие является динамичным и подвижным - с изменением внешних условий равновесие сдвигается в одну или в др. сторону; б/м изменение внешних условий влечет за собой б/м изменение состояния равновесия. Т.о., химические реакции могут протекать как термодинамически равновесные процессы, т.е. к ним можно применять общие условия термодинамического равновесия.
Изменение G системы, в которой протекает химическая реакция, определяется уравнением :
dG = - SdT + VdP + m1dn1 + m2dn2 + ...
Однако в этом случае изменения масс компонентов dn1, dn2 ... не являются независимыми, а связаны стехиометрическими соотношениями :
n1А1 + n2А2 + ... = n1¢А1¢ + n2¢А2¢ + ...
Рекомендуемые материалы
Изменения масс компонентов, выраженные в молях, пропорциональны стехиометрическим коэффициентам уравнения реакции, взятым с соответствующим знаком («-» для исчезающих веществ, «+» - для образующихся) :
 =
=  = ... =
= ... =  =
=  = ... = dc
= ... = dc
изменения масс изменения масс
исходных веществ продуктов реакции
Отношение dni/ni одинаково для всех участников химической реакции и может быть записано в форме дифференциала некоторой величины c. c - химическая переменная : показывает массу каждого компонента, вступившую к данному моменту в реакцию и измеренную в эквивалентных единицах, отвечающих уравнению реакции. Химическая переменная характеризует только одну определенную химическую реакцию. Если в системе протекает несколько реакций, то для каждой из них имеется своя химическая переменная (c1 , c2 ...).
dG = VdP - SdT - n1m1dc - n2m2dc - ... + n1¢m1¢dc + n2¢m2¢dc + ... =
= VdP - SdT + å(nimi)dc
Здесь G = G (P, T, c) ,  = ånimi
= ånimi
Частная производная G по химической переменной равна алгебраической сумме произведений nimi .
При P,T = const : (¶G)P,T = å(nimi)dc
Для реакций, протекающих самопроизвольно при P,T = const , dG < 0 Þ å(nimi) < 0 , т.к. dc > 0 (по определению).
Когда реакция находится в состоянии равновесия, функция G = f (c) имеет минимальное значение :
 = åni mi = 0 - это условие химического равновесия (в общей форме)
= åni mi = 0 - это условие химического равновесия (в общей форме)
Аналогично можно вывести :
 = ånimi = 0 в состоянии равновесия.
= ånimi = 0 в состоянии равновесия.
ЗАКОН ДЕЙСТВИЯ МАСС (ЗДМ).
Связь между равновесными концентрациями (или парциальными давлениями) веществ, участвующих в химической реакции, выражается законом действия масс, количественная формулировка и кинетический вывод которого были даны Гульдбергом и Вааге (1867).
n1А1 + n2А2 Û n1¢А1¢ + n2¢А2¢
v1 = k1 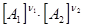 - скорость прямой реакции
- скорость прямой реакции
v2 = k2 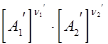 - скорость обратной реакции
- скорость обратной реакции
v1 = v2 в состоянии равновесия
k1 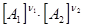 = k2
= k2 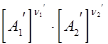
КС = k1 / k2 = 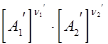 /
/ 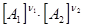
(КС - константа равновесия, выраженная через концентрации)
ЗДМ можно вывести из уравнения ånimi = 0 , если химические потенциалы выразить как функции концентраций, парциальных давлений и т.д. компонентов, участвующих в реакции :
mi = Gi (T) + RT ln Ci 
mi = Gi¢(T) + RT ln Pi - если компоненты - идеальные газы
mi = Gi¢¢(T,P) + RT ln Ni
mi = mi (T) + RT ln fi - если компоненты - реальные газы
mi = mio (T) + RT ln Ni - если компоненты - идеальные растворы
mi = mio (T) + RT ln ai - если компоненты - реальные растворы
Выведем ЗДМ для газовой реакции, если компоненты - идеальные газы. Исходное уравнение mi = Gi¢(T) + RT ln Pi подставим в уравнение ånimi = 0.
åni Gi¢(T) + RT åni ln рi, равн = 0
åni ln рi, равн = -  = f (T)
= f (T)
Опустим индекс (равн); заменим сумму логарифмов логарифмом произведения рi ; а f (T) - логарифмом некоторой функции КР (Т) :
ln  = -
= -  = ln KP (T)
= ln KP (T)
 =
=  = KP (T)
= KP (T)
Величина КР, выраженная через равновесные парциальные давления в идеальной газовой смеси, есть функция только Т и не зависит от суммарного Р и парциальных давлений компонентов в исходной смеси. При T = const KP = const.
КР - константа химического равновесия , а уравнение называется законом действия масс.
Если газ - реальный, то таким же путем получим :
Kf =  ; Kf ® KP при Р ® 0
; Kf ® KP при Р ® 0
В применении к конкретной химической реакции синтеза аммиака :
N2 + 3H2 Û 2NH3
KP =  ; Kf =
; Kf = 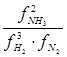
Вид выражения для КР и ее числовое значение зависят от того, в каком направлении и для каких количеств записано стехиометрическое уравнение реакции :
 N2 +
N2 +  H2 Û NH3 2NH3 Û N2 + 3H2
H2 Û NH3 2NH3 Û N2 + 3H2
КР¢ =  =
=  КР¢¢ =
КР¢¢ =  =
= 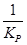
Необходимо различать константы равновесия, выраженные разными способами, т.к. их числовые значения неодинаковы. К выражают : через рi , сi , Ni .
В лекции "Проблема доступа к архивным документам" также много полезной информации.
KP =  ; KC =
; KC =  ; KN =
; KN = 
Связь между ними можно установить, используя уравнения для идеальной газовой смеси : Pi = CiRT Þ KP = KC (RT)Dn
Pi = NiP Þ KP = KN PDn
Dn = n1¢ + n2¢ + n3¢ + ... - n1 - n2 - n3 - ...
Т.к. КР не зависит от Р (для идеальных газов), то и КС от него не зависит. KN же зависит от Р и не зависит от исходных количеств компонентов.
Если Dn = 0, т.е. реакция протекает без изменения числа молекул, то КР = КС = КN .






















