Влияние промоторов и каталитических ядов, обратимая и необратимая дезактивация катализаторов
29. Влияние промоторов и каталитических ядов, обратимая и необратимая дезактивация катализаторов.
Окончательные свойства катализаторов формируются под действием реакционной среды. Изменения состава катализаторов в процессе реакции могут быть следующими:
1) химические изменения, приводящие к фазовым превращениям активного компонента;
2) изменения объемного состава без фазовых превращений;
3) изменения состава поверхностного слоя катализатора.
Воздействие реакционной среды может привести к изменению соотношения компонентов, входящих в состав катализатора, а также к растворению новых компонентов или частичному удалению старых.
Стабильный состав катализатора определяется соотношением скоростей связывания или расходования определенного компонента катализатора в результате взаимодействия с реагирующими веществами. В соответствии с изменением степени превращения реагирующих веществ, стационарный состав катализатора, а, следовательно, и его свойства могут существенно изменяться вдоль слоя катализатора в реакторе.
Время достижения стационарного состояния может быть при соответствующих условиях, например низкой температуре, весьма значительным. Скорость установления стационарного состава катализатора в определенном интервале температур зависит от того, приближаются ли к температуре измерения активности со стороны более высокой или со стороны более низкой температуры.
Рекомендуемые материалы
Вещества, которые являются катализаторами, отравляются ядами или ингибиторами. Яды полностью снижают активность катализатора, а ингибиторы частично подавляют активность и могут менять селективность катализаторов. Твердые катализаторы на внешней и внутренней (внутри пор) поверхности имеют активные центры — полиэдры. Эти активные центры на поверхности распределяются по энергиям (активированной адсорбции и хемосорбции), и их доля от общей поверхности катализатора составляет от 1 до 10 процентов. На этом основании для полного отравления катализатора, т. е. снижения их каталитической активности до нуля, требуется также малое количество яда. Следовательно, молекулы яда при адсорбции их на поверхности катализатора покрывают не всю поверхность катализатора, а лишь активную ее часть, активные центры, тем самым отравляя действие всего катализатора для химического процесса.
Причины дезактивации. Отравление катализаторов.
Отравление катализатора — это частичная или полная потеря активности под действием небольшого количества веществ, называемых контактными ядами или ингибиторами.
Яды полностью снижают активность катализатора.
Ингибиторы частично подавляют активность и могут менять селективность катализаторов.
Твердые катализаторы на внешней и внутренней (внутри пор) поверхности имеют активные центры — полиэдры. Эти активные центры на поверхности распределяются по энергиям (активированной адсорбции и хемосорбции), и их доля от общей поверхности катализатора составляет от 1 до 10 процентов. На этом основании для полного отравления катализатора, т. е. снижения их каталитической активности до нуля требуется очень малое количество яда.
Потеря активности происходит вследствие частичного или полного выключения активной поверхности катализатора. Механизм отравления специфичен для данного яда и катализатора и многообразен. Действие яда может быть селективным, что дает возможность повысить избирательность катализатора.
Следовательно, молекулы яда при адсорбции их на поверхности катализатора покрывают не всю поверхность катализатора, а лишь активную ее часть, активные центры, тем самым, отравляя действие всего катализатора для химического процесса.
Устойчивость катализатора к действию контактных ядов является важнейшим критерием его применимости в производстве. Нередко из нескольких предложенных катализаторов принимают для эксплуатации менее активные, но более устойчивые к отравлению.
При отравлении контактных масс различают истинное отравление (необратимое, обратимое, кумулятивное и благоприятствующее) и дезактивация в результате блокировки и спекания.
Истинное отравление
Этот вид отравления наступает при химическом взаимодействии яда с катализатором с образованием каталитически неактивного соединения или в результате активированной адсорбции яда на неактивных центрах катализатора.
При химическом отравлении возрастает энергия активации.
В случае адсорбционного отравления неоднородной поверхности энергия активации может возрастать постепенно. При этом возможно изменение порядка реакции. Адсорбционное отравление однородного катализатора не сопровождается изменением истинной энергии активации, а наблюдаемая активность линейно зависит от концентрации яда на поверхности катализатора.
Отравление может быть обратимым, необратимым, кумулятивным, благоприятствующее.
Обратимое отравление катализатора
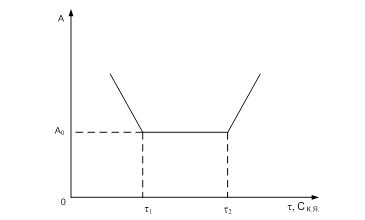
Рис. Зависимость активности катализатора от концентрации контактного яда с течением времени
При обратимом отравлении активность катализатора снижается до определенного уровня, соответствующего концентрации ядовитой примеси, а затем, при дальнейшем увеличении времени отравления, остается неизменной. При прекращении подачи отравляющего вещества в реакционную смесь и замене реакционной смеси свежим сырьем, не содержащим яд, происходит быстрое восстановление активности катализатора.
Обратимое отравление катализатора ядами происходит при умеренном связывании молекул яда с активными центрами или молекулами катализатора.
Обратимое отравление Pt-катализатора осуществляется молекулами СО в реакции гидрирования бензола водородом. При подаче СО в поток реакционной смеси, состоящей из С6Н6 и Н2, активность катализатора постепенно снижается.
После прекращения подачи СО в реакционную смесь активность катализатора через некоторое время возвращается к исходной величине. Это происходит вследствие вытеснения молекул СО с активных центров водородом и С6Н6 и вымыванием их из реакционного объема.
Необратимое отравление катализаторов происходит при химическом взаимодействии молекул или ионов яда с активными центрами катализатора с образованием прочных неактивных соединений. Ядами металлической платины, используемой в реакциях гидрирования циклогексена или разложения Н202, являются ртуть, свинец, висмут, олово. Токсичны для платины Cu+, Ag+, Zn2+, Cd2+, Hg2+, In3+, Ti3+, Co2+, Fe2+.
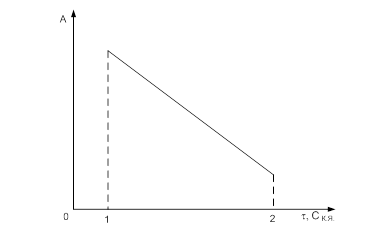
Рис. Зависимость активности катализатора от концентрации контактного яда
При необратимом отравлении резко снижается активность катализатора. Вещества, необратимо отравляющие катализатор, нельзя применять при его изготовлении. Особенно приходится опасаться таких типичных ядов (для ряда процессов), как соединения серы, фосфора, мышьяка и др. Катализаторы гидрирования типа Ni, Pt и Pd отравляются сернистыми соединениями.
Отравляющее действие яда зависит от температуры работы катализатора и давления в реакторе, от природы и способа приготовления катализатора. Отравление катализаторов при температуре Т= 973К и выше не происходит, так как при этой температуре катализаторы часто теряют полностью каталитическую активность из-за структурных изменений, а летучие яды могут полностью разрушаться. Степень отравления катализатора зависит от состава и строения полиэдров в решетке твердых катализаторов. Это отражается в чувствительности катализаторов к яду.
Кумулятивное (накапливающееся) отравление выражается в прогрессирующей дезактивации катализаторов под действием малых количеств ядов, содержащихся в реагентах.
Кумулятивное отравление катализаторов происходит при медленном накоплении отравляющего вещества на катализаторе (на внешней и внутренней поверхности) в ходе проведения соответствующих реакций. Молекулы яда могут накапливаться на катализаторе за счет протекания побочных реакций наряду с целевой реакцией или за счет постепенного извлечения молекул яда из реакционной смеси.
Примером кумулятивного отравления катализаторов является накопление коксовых отложений в процессах превращения углеводородных фракций при крекинге нефтяных фракций на алюмоцеолитсиликатных катализаторах; гидродесульфировании нефтяных фракций на алюмо-кобальт-молибденовых катализаторах; при риформинге бензина на платино-рениевых на оксиде алюминия катализаторах.
Кокс постепенно накапливается на катализаторах, снижая их активность, и чем больше откладывается кокса на катализаторе, тем ниже его активность. Однако активность катализатора может быть восстановлена, если не на 100%, то на 85—90% после выжигания кокса с поверхности закоксованного катализатора в потоке воздуха при температурах выше 773 К.
При крекинге тяжелых нефтяных фракций на цеолиталюмосиликатных катализаторах на их поверхности могут откладываться соединения никеля и ванадия, при окислении которых в потоке воздуха при выжиге кокса образуются оксиды NiO, V2O5 и FeO. Эти оксиды откладываются на поверхности катализатора и необратимо снижают активность катализатора в крекинге. Необратимо снижают активность катализатора пары воды, которые при повышенных температурах оказывают отрицательное влияние на текстуру катализатора.
Механизм отравления связан с химическим составом катализаторов и соответственно типом катализа; он будет различен для электронного (гомолитического) катализа на полупроводниках и металлах и ионного (гетеролитического) катализа. Наиболее сложен механизм отравления на металлических и полупроводниковых контактах. Катализаторы полупроводникового типа более устойчивы к действию ядов, чем металлические. Процесс отравления полупроводниковых контактов изучен значительно меньше, чем металлических.
Благоприятствующее отравление катализаторов происходит, когда вводимые в катализатор яды частично подтравливают отдельные активные центры катализаторов. Этим обеспечивается то, что молекулы яда тормозят образование конечного продукта реакции или снижают образование промежуточных продуктов реакции. Примером благоприятствующего отравления является изменение селективности палладиевого катализатора в реакции гидрирования хлористого бензоила без и с добавкой отравляющих веществ.
Процесс восстановления хлористого бензоила в кипящем толуоле проходит по схеме:
С6Н6СОС1+Н2 --> С6Н5СНО + Н2 --> С6Н5СН2ОН + Н2 --> С6Н5СН3.
На чистом палладиевом катализаторе конечным продуктом являлся толуол. При добавке к смеси хинолина в количестве от 0,1 до 50 мг/кг процесс на катализаторе останавливался на стадии производства бензальдегида, который получали в количестве от 23 до 78—88% мас.
Дезактивация в результате блокировки и спекания
Активность катализатора может уменьшаться не только при истинном отравлении, но и вследствие изменения структурных характеристик, а также при механическом экранировании поверхности катализатора пылью или твердыми веществами, образующимися при катализе (блокировка).
Для тонкопористых катализаторов, работающих при относительно низких температурах, блокировка контактной поверхности может происходить в результате объемного заполнения микро- и переходных пор в процессе адсорбции, капиллярной конденсации или осаждения микротвердых частиц из реагирующей смеси (например, углерода и смол при катализе реакций органических веществ).
Зауглероживание катализаторов наблюдается во многих процессах: крекинг, риформинг, дегидрирование и др. Кокс, образующийся на поверхности катализаторов, всегда содержит некоторое количество водорода и по химическому строению представляет собой высококонденсированные ароматические углеводороды. Образование кокса принято считать побочной стадией основного каталитического процесса. По существующим данным, кокс на катализаторах откладывается до определенного предела.
Фактическое содержание кокса зависит от температуры, природы сырья, пористой структуры и химического состава катализаторов.
При блокировке, как правило, не изменяется ни энергия активации катализатора, ни его избирательность (исключая процессы в диффузионной области), поскольку действие блокирующего вещества сводится к выключению отдельных участков активной поверхности.
Активность контактных масс может также снижаться при изменении пористой структуры под действием высоких температур (спекание).
Спекание — это агрегация мелких частиц в более крупные, что приводит к уменьшению активной поверхности катализатора и соответственно к понижению его активности. Движущей силой спекания является разность термодинамических потенциалов мелких и крупных частиц. Спекание, видимо, реализуется по двум механизмам: вследствие диффузии частиц и за счет переноса атомов.
Регенерация контактных масс
Через определенное время, которое может составлять от нескольких секунд до нескольких лет, активность катализатора уменьшается до уровня, который делает продолжение работы экономически нецелесообразным. Может уменьшиться и его селективность. В таких случаях загруженный катализатор нужно регенерировать или заменить. Регенерацию катализатора осуществляют в том же каталитическом реакторе посредством пуска смеси другого состава или же катализатор выгружают и регенерацию производят где-либо в другом месте.
При обратимом отравлении для регенерации достаточно удаления яда из исходного сырья. В некоторых случаях требуется дополнительная обработка катализатора. Например, если Ni -катализатор дезактивируется добавками кислорода, его восстанавливают водородом, что приводит к восстановлению его активности, близкой к первоначальной.
Никель, необратимо отравленный серой, при обработке водяным паром или кислородом переводит серу в еще более трудно удаляемый сульфат. На практике эти катализаторы не регенерируют. Нанесенные катализаторы после спекания также не регенерируют.
Катализаторы, содержащие Pt, Pd, Rh и другие, удаляют из реактора для извлечения дорогого благородного металла.
Для регенерации закоксованного катализатора крекинга поток реакционной смеси через катализатор прекращают и катализатор нагревают в окислительной атмосфере, так что происходит окисление или «сгорание» кокса.
Основная задача при регенерации закоксованного катализатора - уменьшение роста температуры, вызванного экзотермической реакцией окисления кокса в СО и СО2. Нежелательный подъем температуры при регенерации может привести к спеканию катализатора. Одним из возможных решений является применение малых концентраций кислорода в начальных стадиях регенерации.
Исследование кинетики сгорания отложенного кокса показало, что СО и СО,, являются первичными продуктами сгорания углерода. Отношение СО/СО2 почти не зависит от того, в какой форме находится углерод; оно составляет 0.3-0.9 и растет с температурой процесса. Общая скорость сгорания углерода в закоксованном катализаторе определяется или кинетикой окисления С в порах гранулы, или диффузией кислорода в порах катализатора, а также одновременно кинетикой реакции и диффузией через поры. При увеличении температуры происходит переход от кинетической области сгорания кокса через переходную к диффузионной. Для катализаторов крекинга с размером частиц ~4 мм кинетическая область наблюдается до 475°С, диффузионная область начинается при температурах выше 625 °С. При низких температурах кислород имеет доступ ко всем местам выделения кокса по всему объему зерна. При высоких температурах процесс лимитируется диффузией кислорода сквозь поры.
Необходимо отметить, что при регенерации происходит не только выжигание кокса, но и изменение самого катализатора под действием окислительной среды. Катализатор при регенерации может менять структуру, химический состав, пористость и удельную поверхность.
Если дезактивация происходит вследствие осаждения металла из примесей в сырье, простая процедура окисления не годится. В этом случае катализатор выгружают из реактора и подвергают полной переработке.
В зависимости от природы отравляющих катализатор веществ или от причины потери активности разрабатываются методы регенерации катализаторов в промышленных условиях.
Регенерация контактных масс столь же специфична, как и их отравление.
В каждом случае выявляют причину снижения активности и изменения селективности катализатора и разрабатывают методы его регенерации.
Из возможных путей восстановления активности контактных масс наиболее существенными являются следующие:
1. летучий яд может быть удален с поверхности катализатора током чистого газа, жидкости или повышением температуры.
2. при химическом взаимодействии яд может перейти в нетоксичную, слабо адсорбированную форму.
3. промывка катализаторов жидкими растворителями.
4. обработка смесью газов, которые являются восстановителями или окислителями.
Пример. Катализаторы, потерявшие активность вследствие блокировки поверхности при коксообразовании, регенерируются путем выжигания кокса кислородом воздуха при 550-700оС.
От оксидов ванадия и никеля катализатор можно освободить растворением их в водных растворах неорганических кислот.
Промоторы
Промоторы – это вещества, которые сами не обладают каталитическими свойствами или мало активны, но при добавлении их к катализатору даже в небольшом количестве, увеличивают активность катализатора.
Промоторы в твердые катализаторы вводят в момент их синтеза.
Эффективность действия промотора зависит, прежде всего, от их количества. При оптимальном соотношении катализатора и промотора соблюдается максимальная активность. Повышенное количество промотора сверх оптимального могут приводить к снижению активности катализатора.

Рис. Зависимость активности катализатора от количества промотора.
1 – кривая активности катализатора.2 - кривая активности промотора.
Промоторы делятся на 2 группы:
1 – Текстурные, которые оказывают физическое воздействие в каталитической системе.
2 – Структурные, которые оказывают химическое воздействие в каталитической системе.
Текстурные промоторы присутствуют в катализаторе, как правило, в виде мелких частиц и оказывают тормозящее действие на спекание активной фазы.
Эффективность действия текстурного промотора напрямую связана с его дисперсностью, которая должна быть значительно выше, чем у собственно катализатора.
Пример: мелкие частицы Al вводят в железный катализатор синтеза аммиака, количество 0,5 – 1,5%; оксид хрома в катализатор синтеза ментола на основе оксида Zn 0,5 – 4% - предотвращает спекание.
Текстурные промоторы не изменяют энергию активности реакции.
Структурные промоторы изменяют химический состав катализатора. Механизм их действия очень сложен, и воздействие может идти следующими путями:
1. промоторы могут ускорять образование промежуточных соединений.
2. они могут создавать дефекты в кристаллической решетке.
3. они могут изменять электронную структуру катализатора, т.е. облегчать присоединение или отрыв электронов.
4. они существенно меняют энергию активации.
Модификаторами называются такие вещества, которые при добавлении к катализатору меняют его активность по полиэкстремальной зависимости.
Активаторами называют вещества, которые вводят в реакционную смесь и которые изменяют активность катализатора. Они могут быть астехиометрическими и стехиометрическими компонентами.
Астехиометрические участвуют в химическом процессе в составе реакционной среды, но после окончания реакции выделяются в неизменном виде.
Стехиометрические сами участвуют в каталитическом процессе, изменяют скорость реакции и сами участвуют в химическом превращении.
Смешанные катализаторы – в них практически все компоненты находятся в соизмеримых количествах, и являются активными в отношении данной реакции.
Составляющие смешанных катализаторов в процессе их приготовления могут реагировать между собой с образованием нового, более активного соединения (железомолибденовый катализатор окисления метанола в формальдегид). В процессе приготовления образует молибдат железа – когда соотношение оксидов молибдена и железа равно 1,5:1, катализатор имеет определенную активность. При изменении соотношения получаем систему с избытком оксида или Fe, или Мо, и активность катализатора резко падает. Тоже самое происходит в железомедном катализаторе окисления серы, он состоит из соединений типа: CuFeO2, CuFeO4, что обеспечивает повышение активности, по сравнению с чистыми оксидами железа и меди.
Катализаторы на носителях
Наиболее широко распространенными являются катализаторы на носителях. Это связано с экономией дорогостоящих каталитических компонентов и с относительной легкостью формирования пористой структуры носителя по сравнению с формированием пористой структуры смешанных катализаторов.
При подборе носителя следует учитывать:
1. необходимые механические свойства: прочность на раздавливание, истирание, твердость.
2. стабильность в условиях реакции и регенерации - термостойкость, коррозийная устойчивость
3. пористость носителя – определяется средним радиусом пор, распределение объема пор по радиусу.
Пористая структура связанна с природой вещества, образующего носитель, и часто находится в обратной зависимости от величины прочности.
Первыми носителями были природные глины, они были доступны и прочны, но имели непостоянный химический состав, и часто содержали в своем составе контактные яды.
Поэтому сейчас наибольшее применение имеют синтетические носители.
Преимущества:
1. постоянный химический состав;
2. возможность регулирования пористой структуры, что позволяет ее ликвидировать и получать высокоактивный катализатор.
3. возможность получения катализатор в виде гранул заданной формы.
Наибольшие успехи в получении Al2O3, SiO2 и активированного угля.
Носитель должен иметь высокую температуру спекания. Обычно спекание начинают при температуре, составляющую ½ от температуры плавления, У металлов подвижность поверхностных частиц наступает при температуре в 3 раза ниже температуры плавления. (Cu, Ag, Au tпл = 1300К, они должны быть нанесены на носитель). Температура плавления переходных металлов (Fe, Co, Ni) =1800К. Благородные металлы очень тугоплавкие, теоретически их можно использовать в виде самих металлов, но в целях экономии наносятся на носитель.
Тип и характер пористой структуры носителя
Распределение активного компонента по зерну определяет тип и характер пористой структуры носителя.
Существует 4 типа распределения:
1. с равномерным распределением активного компонента по объему гранулы;
2. распределение активного компонента по внешней поверхности гранулы;
3. распределение активного компонента в центре гранулы;
4. распределение активного компонента в слое, удаленном от внешней поверхности гранулы.
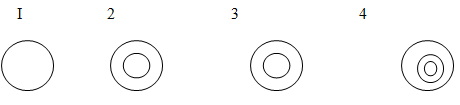
Рис. Распределение активного компонента по зерну
1 тип для реакций в кинетической области, 2 – в диффузионной области, 3, 4 – используются наиболее редко, А - конечное.
- конечное.
Первый тип – путем смешения компонентов, их соосаждения или пропитки. Второй тип – при пропитке, 3,4 типы – путем последовательного осаждения компонентов или методом сухой грануляции.
Теоретически нанесенные контактные массы делятся на две группы:
- сорбционные
- пропиточные.
В первой сорбционной группе катализаторов активная часть связывается полностью с поверхностью носителя, за счет сорбции на стадии пропитки, а вторая пропиточная группа заключается в том, когда количество активного компонента, связавшегося на стадии пропитки за счет сорбции очень мало, а основная масса этого активного компонента связалась при сушке путем механического осаждения.
Первый тип – Pt адсорбируется на Al2O3: из слабого раствора H2PtCl6 Pt сорбируется на носитель;
Второй вариант – Ag на пемзе: раствор соли Ag на пемзу, подсушивается и соль распадется, Ag осаждается на пемзу, а оксид выпадает.
Активность активного вещества связаны непосредственно с положением элемента в периодической системе.
Обычно их подбирают эмпирическим методом по:
1. Активность элемента в окислительно-восстановительных реакциях.
Наибольшей активностью обладают металлы 8-ой группы, содержащей элементы с частично незаполненной d-оболочкой, хотя здесь и наблюдаются различия в зависимости от типа реакции. Pt активно работает в реакциях восстановления, а Pd в реакциях гидрирования. В этих же реакциях активными бывают и довольно широко используются редкоземельные элементы с недостроенными f-оболочками. Для них существует положение: с увеличением числа d-электронов активность проходит через максимум. Этот максимум определяется природой каталитической реакции, поэтому точно исследован. Элементы, расположенные в правой верхней части таблицы обладают повышенной активностью в реакциях дегидратации и крекинга. Наиболее сложен этот вопрос о каталитической активности оксидов этих металлов, т.к. приходится учитывать характер химической связи между элементами, структуру кристаллической решетки оксидов, и также свойства, такие как полупроводниковые.
2. Кислотно-основной катализ.
В периодической системе в пределах групп кислотность соединений и соответственно их активность снижаются с увеличение порядкового номера элемента. При перемещении в больших периодах с лева на право кислотность соединений и каталитическая активность возрастает. Для реакции основного характера эта зависимость обратная.
При подборе активного вещества следует учитывать также, что катализатор должен обладать химическим сродством по отношению к хотя бы одному из компонентов реакции. Химически инертные вещества и вещества, которые образуют прочные соединения с реагентами, исключаются из состава катализатора. Активность оксидов металла возрастает с понижением энергии связи кислорода. Она зависит от легкости изменения валентного состояния катиона металла в этом оксиде.
Отсюда вытекает два практических предложения:
1. Использовать оксиды металлов с переменной валентностью, как носителей или активных веществ;
2. Использовать их в качестве добавок к катализаторам. Добавки оксидов, содержащих более электроотрицательный катион понижают энергию связи О2 и повышает активность, возрастающую с повышением порядкового номера элемента.
Энергетические факторы следует сочетать со структурным соответствием молекул реагентов катализаторов. Если расстояние между атомами кислорода в каком-либо оксиде металла близко в длине связи С – С в какой-либо молекуле, то такие оксиды хорошие катализаторы окисления.
При подготовке носителя (катализатора) к работе следует учитывать его прочность. Если катализатор предназначен для использования в виде неподвижного слоя, его прочность должна быть такой, чтобы он мог противостоять потоку газа или жидкости и любым вибрациям и смещениям, которые возникают при движении потока. Если катализатор используют во взвешенном состоянии, нужно учитывать трение между частицами катализатора, трение этих частиц о стенки реактора, подводящие трубки, вентили, цилиндры насоса или компрессора.
Ещё посмотрите лекцию "Функции менеджмента" по этой теме.
Очень важно, чтобы плотность катализатора соответствовала условиям проведения процесса. При использовании во взвешенном состоянии частицы катализатора не должны выпадать из взвеси, а сохраняться во взвешенном состоянии при механическом или газовом перемешивании. Для этого плотность катализатора в сухом состоянии должна составлять от 1 до 0,2 или 0,3 г/см3. Важным обстоятельством при определении плотности катализатора является его стоимость. Поскольку многие катализаторы продаются на вес, желательно, чтобы плотность катализатора была как можно более низкой, чтобы для заполнения реактора потребовалась минимальная масса. В условиях псевдоожиженного слоя плотность катализатора должна соответствовать скоростям газовых потоков: во-первых, катализатор должен быть таким, чтобы его можно было перевести во взвешенное состояние, во-вторых, он не должен быть слишком легким, чтобы его не уносило из зоны реакции в виде пыли, которую придется улавливать в выходящем газовом потоке. Здесь еще раз надо упомянуть о твердости: движение взвешенных частиц вдоль стенок реактора или через регенерационную систему должно происходить по возможности без чрезмерного истирания стенок оборудования.
Еще одной важной характеристикой катализатора и носителя является величина поверхности. Для реакций в газовой фазе обычно желательно иметь катализаторы с большой поверхностью, однако, в общем случае это не всегда так. В частности, при реакциях в паровой фазе с участием больших и сложных молекул, большая поверхность может только мешать, поскольку узкие поры, составляющие основу развитой поверхности, затрудняют и замедляют диффузию больших молекул. Для жидкофазных реакций ввиду большей плотности среды важно, чтобы размер пор был относительно невелик, а значит, поверхность относительно мала. Небольшой считается удельная поверхность от 1 до 125 м2/г, а высокоразвитой — в интервале 125—2000 м2/г. Столь большая удельная поверхность — 2000 м2/г — характерна для некоторых видов активного угля. Величина поверхности имеет также большое значение в тех случаях, когда носитель пропитывают сокатализатором или каталитически активный компонент наносят пропиткой. Когда поверхность велика, то есть поры имеют малый диаметр, то совершенно очевидно, что большая часть пор будет заполнена и заблокирована катализатором, а следовательно, и в этом случае более желательна меньшая поверхность с порами большего диаметра.
Четвертой основной характеристикой катализатора или носителя является общий объем пор, который имеет огромное значение, поскольку определяет размер доступной для реакции доли поверхности катализатора, идет ли речь о системе катализатора с носителем или о самом носителе. Вероятно, при оптимизации свойств катализатора эта характеристика учитывается в последнюю очередь, но она оказывает столь сильное влияние на упомянутые выше характеристики, что, в конечном счете, играет решающую роль.
Чрезвычайно важным является распределение пор по размерам. В ряде случаев необходимо наличие больших пор, иногда, напротив, совсем маленьких. Но, вероятно, в большинстве случаев желательно наличие и тех и других, причем в таком соотношении, чтобы основная часть поверхности и объема пор приходилась на долю малых пор. Под малыми в общем случае следует понимать поры с диаметром 60 А и меньше, большие поры имеют от 60 до 400 А в диаметре.
Распределение пор также является специфической характеристикой данного катализатора. Если катализатор используется в виде крупных гранул или шариков, распределение пор должно быть таково, чтобы имелись большие сквозные поры, обеспечивающие свободный доступ газов или жидкостей к более мелким порам, в которых в основном и происходит реакция. С другой стороны, если частицы малы, как это бывает в условиях взвешенного слоя, поры могут быть однородными, сравнительно небольшими, поскольку необходимость в больших проходных порах отпадает из-за того, что в данной системе реагенты имеют свободный доступ на всю глубину.
Разумеется, все эти характеристики катализатора или носителя взаимосвязаны и катализатор должен сочетать в себе все эти качества, чтобы иметь оптимальные свойства для данного каталитического процесса. Многие из указанных характеристик катализатора могут быть подобраны лишь после промышленных испытаний, причем обычно спустя довольно большое время, когда более определенно будут установлены истираемость и срок жизни катализатора.





















