Термодеструктивные процессы переработки нефтяного сырья
20. Термодеструктивные процессы переработки нефтяного сырья: типы и назначение термодеструктивных процессов, их химизм, механизм, термодинамика и кинетика.
Под термодеструктивными процессами (термолизом) подразумевают процессы химических превращений нефтяного сырья - совокупности реакций крекинга (распада) и уплотнения, осуществляемые термически, то есть без применения катализаторов и водорода. Основными параметрами термических процессов, влияющие на материальный баланс, ассортимент и качество получаемых продуктов являются свойства сырья, давление, температура и продолжительности процесса.
В современной нефтепереработке применяются следующие типы термодеструктивных процессов:
1. Термический крекинг высококипящего дистиллятного или остаточного сырья при повышенном давлении (2 – 4 МПа) и температуре 500 – 540оС с получением газа и жидких продуктов.
С начала возникновения и до середины ХХ в. основным назначением этого «знаменитого» в свое время процесса было получение из нефтяных остатков дополнительного количества бензинов, обладающих, по сравнению с прямогонными, повышенной детонационной стойкости (60 – 65 пунктов по ОЧММ), но низкой химической стабильностью. В связи с внедрением и развитием более эффективных каталитических процессов, таких, как каталитический крекинг, каталитический риформинг, алкилирование и др., процесс термического крекинга остаточного сырья как производящий бензин утратил свое промышленное значение. В настоящее время термический крекинг применяется преимущественно как процесс подготовки дистиллятных видов сырья для установок коксования и производства термогазойля. Применительно к тяжелым нефтяным остаткам промышленное значение в современной нефтепереработке имеет лишь разновидность этого процесса, получивший название висбрекиига, процесс легкого крекинга с ограниченной глубиной термолиза, проводимый при пониженных давлениях (1,5 - 3 МПа) и температуре с целевым назначением снижения вязкости котельного топлива.
2. Коксование длительный процесс термолиза тяжелых остатков или ароматизированных высококипящих дистиллятов при невысоком давлении и температурах 470 - 540 °С. Основное целевое назначение коксования производство нефтяных коксов различных марок в зависимости от качества перерабатываемого сырья. Побочные продукты коксования - малоценный газ, бензины низкого качества и газойли.
3. Пиролиз - высокотемпературный (750 - 800 °С) термолиз газообразного, легкого или среднедистиллятного углеводородного сырья, проводимый при низком давлении и исключительно малой продолжительности. Основным целевым назначением пиролиза является производство непредельных газов. В качестве побочного продукта при пиролизе получают высокоароматизированную жидкость широкого фракционного состава с большим содержанием непредельных углеводородов.
4. Процесс получения технического углерода (сажи) исключительно высокотемпературный (свыше 1200 С) представляет собой термолиз тяжелого высокоароматизироваиного дистиллятного сырья, проводимый при низком давлении и малой продолжительности. Этот процесс можно рассматривать как жесткий пиролиз, направленный на производство твердого высокодисперсного углерода - продукта глубокого термического разложения углеводородного сырья на составляющие элементы.
5. Промесс получения нефтяных пеков (пекование) – новый, внедряемый в отечественную нефтепереработку процесс термолиза (карбонизации) тяжелого дистиллятного или остаточного сырья, проводимый при пониженном давлении, умеренной температуре (З60-- 420 °С) и длительной продолжительности. Помимо целевого продукта пека - в процессе получают газы и керосино - газойлевые фракции.
Рекомендуемые материалы
6. Процесс получения нефтяных битумов - среднетемпературный продолжительный процесс окислительной дегидроконденсации (карбонизации) тяжелых нефтяных остатков (гудронов, асфальтов деасфальтизации, экстрактов масляного производства и др.), проводимый при атмосферном давлении и температуре 250 - 300°С.
В этих процессах одновременно и совместно протекают как эндотермические реакции крекинга (разложение, дегидрирование, деалкилирование, деполимеризация, дегидроциклизация), так и экзотермические реакции синтеза (гидрирование, алкилирование, полимеризация, конденсация) и частично реакции изомеризации с малым тепловым эффектом. Об этом свидетельствует то обстоятельство, что в продуктах термолиза (и катализа) нефтяного сырья всегда содержатся углеводороды от низкомолекулярных до самых высокомолекулярных: от водорода и сухих газов до смолы пиролиза, крекинг-остатка и кокса или дисперсного углерода (сажи). В зависимости от температуры, давления процесса, химического состава и молекулярной массы сырья возможен термолиз с преобладанием или реакций крекинга, как, например, при пиролизе низкомолекулярных углеводородов, или реакций синтеза как в жидкофазном процессе коксования тяжелых нефтяных остатков. Часто термические и каталитические процессы в нефте- и газопереработке проводят с подавлением нежелательных реакций, осложняющих нормальное и длительное функционирование технологического процесса.
Термодинамическая вероятность протекания химических реакций, независимо от того, являются они или нет термическими или каталитическими (поскольку катализатор не влияет на равновесие реакций), определяется знаком и величиной изменения свободной энергии Гиббса ∆G в процессе.
Отрицательное значение ∆G при температуре Т и давлении Р означает, что при этих условиях данная химическая реакция может протекать самопроизвольно. При этом, чем больше абсолютное значение отрицательной величины ∆G, тем больше вероятность протекания реакции и тем больше будут равновесные концентрации ее продуктов.
Данные по свободной энергии образования углеводородов при различных температурах и стандартном давлении показывают, что ∆G для всех углеводородов зависит от молекулярной структуры и существенно возрастает с ростом их молекулярной массы и повышением температуры. Отсюда следует вывод о том, что высокомолекулярные углеводороды, обладающие, по сравнению с низкомолекулярными, большим запасом энергии образования ∆G, термически менее стабильны и более склонны к реакциям распада, особенно при высоких температурах термолиза.
Поскольку в реакциях крекинга из исходных высокомолекулярных углеводородов образуются низкомолекулярные, а при синтезе, наоборот, низкомолекулярные превращаются в высокомолекулярные продукты, то эти две группы реакций термолиза должны антибатно различаться не только по тепловым эффектам (эндо- и экзотермические), но и по температурной зависимости энергии Гиббса ∆G.
Как следует из рис. 41, значения ∆G с ростом температуры уменьшаются для эндотермических реакций крекинга углеводородов и повышаются для экзотермических реакций синтеза (на рисунке отложены отрицательные значения ∆G). Это означает, что термодинамическая вероятность протекания реакций возрастает в эндотермических реакциях крекинга с повышением температуры, а в экзотермических реакциях синтеза - наоборот, при понижении температуры. По этому признаку реакции крекинга являются термодинамически высокотемпературными, а синтеза - термодинамически низкотемпературными.
Качественно аналогичный вывод вытекает и из принципа Ле-Шателье: повышение температуры способствует протеканию эндотермических реакций слева направо, а экзотермических реакций - в обратном направлении.
Следует отметить, что в интервале температур, имеющем место в промышленных процессах нефтепереработки (300-1200°С), энергия Гиббса изменяется от температуры по линейной зависимости. Причем знак температурного коэффициента в этом уравнении зависит от энергетики реакций: для эндотермических реакций коэффициент > 0 и для экзотермических - наоборот, коэффициент < 0. Численное значение коэффициента зависит от величины теплового эффекта: оно увеличивается симбатно с ростом теплового эффекта реакций. Так, в реакциях малым тепловым эффектом (например, изомеризации и гидрокрекинга) энергия Гиббса слабо зависит от температуры, в то время как для сильно эндо- и экзотермических реакций она изменяется от температуры значительно сильнее.
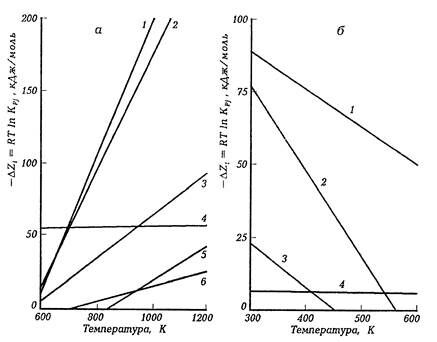
Рис. 41. Температурная зависимость изменения энергии Гиббса для эндотермических реакций деструкции углеводородов (а): 1 - дегидроциклизации н-гептана (С7Н16 = С6Н5СН3 + 4Н2); 2 -дегидрирования циклогексана (С6Н12 = С6Н6 + 3 Н2); 3- крекинга (н.С20Н42 = С10Н22 + С10Н20; 4 - гидрокрекинга (н.С20Н42 + Н2 = 2 С10Н22); 5-деалкилирования этилбензола (C6H5C2Н5 = С6Н6 + C2H4; 6-циклизации н-гептана (С7Н16 = С6Н11СНз + Н2) и экзотермических реакций (б): 1 - гидрирования н-бутена в бутан; 2 - полимеризации н.бутена (3 С4Н8 = С12Н24); 3 - алкилирования изобутана изобутиленом в изооктан (2,2,4 триметилпентан); 4 – изомеризациии н.пентана в изопентан
Для реакций, идущих с изменением мольности, то есть объема системы, на состояние равновесия оказывает влияние не только температура, но и давление. Исходя из принципа Ле-Шателье, следует, что повышение давления способствует реакциям синтеза, идущим с уменьшением объема. Наоборот, для реакций крекинга, идущих с увеличением объема, благоприятны низкие давления. Для реакций, протекающих без изменения объема, таких, как изомеризация или замещение, давление не оказывает влияния на их равновесие.
Для прогнозирования вероятности образования того или иного продукта реакций в термодинамике пользуются данными по энергиям связи в химических веществах.
Энергией связи называется количество энергии, необходимое для разрыва или образования определенного типа связи между атомами в молекулах. При возникновении связи происходит переход химической системы в более устойчивое состояние, сопровождающееся выделением тепла. Следовательно, энергия образования связи положительна. При распаде молекул тепло поглощается, и энергия разрыва связи отрицательна.
Из анализа вышеприведенных данных, можно сформулировать некоторые качественные выводы о влиянии структуры и массы молекул углеводородов на величину энергий разрыва связей между атомами углерода, углерода с водородом и углерода с серой.
1. В молекулах алканов энергия разрыва связи между крайним атомом углерода и водородом наибольшая в метане (431 кДж/моль, и она снижается по мере увеличения числа углеродных атомов до 4 и затем становится постоянной (па уровне 394 кДж/моль).
2. В нормальных алканах энергия разрыва связи между атомами водорода и находящегося внутри цепи углерода постепенно уменьшается в направлении к середине цепи (до 360 кДж моль). Например, в молекуле нормального октана она составляет; 394; 373, 364; 360, 360; 364; 373; 394.
3. Энергия отрыва атома водорода от вторичного и особенно от третичного атома углерода несколько меньше, чем от первичного.
4. В молекуле алкенов энергия отрыва атома водорода, от углеродного атома с двойной связью значительно больше, а от атома углерода, находящегося в сопряжении с двойной связью, значительно ниже, чем энергия С-Н-связи в алканах.
5. В нафтеновых кольцах прочность связи С-Н такая же, как в связях вторичного атома углерода с водородом в молекулах алканов.
6. В молекулах бензола и алкилароматических углеводородов энергия связи между атомом углерода в кольце и водородом сопоставима с прочностью С- Н-связи в метане, а энергия отрыва водорода от углерода, сопряженного с ароматическим кольцом, значительно ниже, чем энергия С-Н-связи в алканах.
7. Энергия разрыва углерод - углеродной связи в молекулах всех классов углеводородов всегда ниже энергии С-Н-связи (примерно на 50 кДж/моль).
8. В молекулах алканов длина, строение цепи и местоположение разрываемой связи оказывают влияние на энергию разрыва углерод - углеродной связи качественно аналогично влиянию их на прочность С-Н-связи. Так, связь между крайними углеродными атомами ослабляется по мере увеличения числа углеродных атомов (от 360 для этана до 335 кДж/моль для пентана и выше), а связь между внутренними углеродными атомами по мере приближения к середине пени (до 310 кДж/моль). Например, энергия разрыва связи С-С в молекуле н-октана в зависимости от ее местоположения изменяется следующим образом. 335; 322; 314; 310; 314; 322; 335 кДж/моль.
9. Связи между первичными атомами углерода всегда прочнее, чем С С-связи в комбинациях с первичным, вторичным (Сьт) и третичным (Стр) атомами углерода. Энергия разрыва углерод - углеродной связи (DC-C) уменьшается в следующей последовательности: DC-C > DC-Cвт > DC-Cтр > DCвт-Cвт > DCвт-Cтр > DCтр-Cтр .
В лекции "82 Современная модель строения мицеллы" также много полезной информации.
10. В алкенах углерод - углеродные связи значительно прочнее (но менее чем в 2 раза), чем С-С-связи в алканах. Так, энергия разрыва С-С-связи в этилене составляет 500 кДж/моль. Однако С-С-связи. сопряженные с двойной (то есть находящиеся к ней в β-положении), значительно слабее С-С-связи в алканах.
11. Энергия разрыва углерод - углеродной связи в кольце циклопентана (293 кДж/моль) и циклогексана (310 кДж/моль) несколько меньше С-С-связи в середине цепи нормального гексана (318 кДж/моль).
12. В алкилароматических углеводородах углерод - углеродная связь, сопряженная с ароматическим кольцом (С – Сар) менее прочна, чем связь С-С в алканах. Сопряжение с ароматическим кольцом снижает прочность углерод - углеродной связи приблизительно в такой же степени, как и сопряжение с двойной связью. Сопряжение с несколькими бензольными кольцами снижает прочность С-С-связи еще больше.
13. Энергия разрыва атомов водорода в молекуле водорода (диссоциации) несколько выше С-Н-связи в наиболее термостойком метане и составляет 435 кДж/моль.
14. По прочности связь C-S в меркаптанах и связь S-S в дисульфидах сопоставима со связью С-С в алканах.
Очевидно, что при термолизе углеводородного сырья будут разрываться в первую очередь наиболее слабые связи и образовываться продукты преимущественно с меньшей свободной энергией образования. Таким образом, термодинамический анализ позволяет прогнозировать компонентный состав и подсчитать равновесные концентрации компонентов в продуктах реакции в зависимости от условий проведения термических, а также каталитических процессов. Однако компонентный состав и концентрации продуктов химических реакций в реальных промышленных процессах не всегда совпадают с результатами термодинамических расчетов.





















