Двухатомный газ. Колебания атомов
2.9. Двухатомный газ. Колебания атомов
Колебательная часть термодинамических величин газа становится существенной при значительно более высоких температурах, чем вращательная, потому, что интервалы колебательной структуры велики по сравнению с интервалами вращательной структуры. В таблице приведены характерные колебательные температуры  .
.
Мы будем считать, однако, температуру большой лишь настолько, чтобы были возбуждены в основном не слишком высокие колебательные уровни. Тогда колебания можно считать малыми и гармоническими, а уровни энергии определяются обычным выражением для гармонического осциллятора  . В случае ангармонических колебаний выражение для энергии будет значительно сложнее.
. В случае ангармонических колебаний выражение для энергии будет значительно сложнее.
Вычислим колебательную статистическую сумму
 . (*)
. (*)
Хотя при больших числах v колебания будут ангармоническими, но вследствие очень быстрой сходимости ряда суммирование можно распространить до бесконечности.
Сумма (*) представляет собой геометрическую прогрессию:
 ,
,
откуда свободная энергия
 ,
,
энтропия
 ,
,
энергия  ,
,
и теплоемкость  .
.
На рисунке изображен график зависимости  от
от  .
.
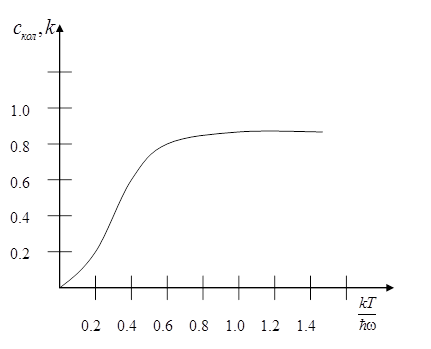
Рис. 2.3
При низких температурах ( ) энтропия и теплоемкость стремятся экспоненциально к нулю:
) энтропия и теплоемкость стремятся экспоненциально к нулю:
 ,
,
 ,
,
а свободная энергия и энергия стремятся к постоянной величине.
При высоких температурах ( ) имеем:
) имеем:
 ,
,
Рекомендация для Вас - 18 Метод Эйлера.
чему соответствует постоянная теплоемкость  .
.
Таким образом, полная теплоемкость двухатомного газа при температурах  (практически уже при
(практически уже при  ) равна
) равна
 ,
,  .
.
Многоатомный газ. Свободную энергию многоатомного газа, как и двухатомного газа, можно представить в виде суммы трех частей- поступательной, вращательной и колебательной.
Благодаря большой величине моментов инерции многоатомных молекул (и соответственно, малости их вращательных квантов) их вращение можно всегда можно рассматривать классически. Эффекты квантования вращения могли бы наблюдаться лишь у метана CH4, где они должны появляться при температурах около 50K.
Многоатомная молекула обладает, в общем случае, тремя вращательными степенями свободы и большим числом колебательных степеней свободы. Если молекула обладает какими-либо осями симметрии, то повороты вокруг этих осей совмещают молекулу саму с собой и сводятся к перестановке одинаковых атомов. Например, если все атомы в молекуле расположены на одной прямой (линейная молекула), то она обладает, как и двухатомная молекула, всего двумя вращательными степенями свободы и одним моментом инерции.



 , К
, К
















