- Основы систематики минералов
Основы систематики минералов.
Систематика минералов, как и любая другая систематика, должна базироваться на общности всех признаков, или тех из них. которые являются сущностными и с которыми все остальные признаки находятся в определенной зависимости. Для минералов такими сущностными признаками являются химизм + структура = конституция минералов.
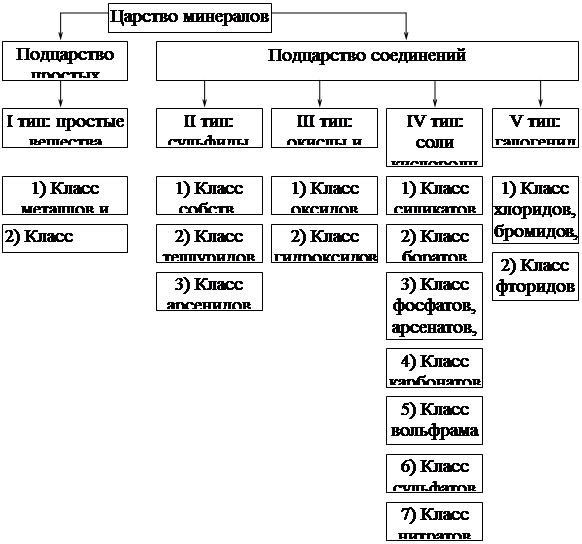
Большинство систематик в минералогии основано на кристаллохимическом принципе, в том числе и систематика В.С.Соболева и А.А.Годовикова, которой мы будем пользоваться в нашем курсе, и в основе которой, как отмечено в самом начале лекции, лежит конституция минералов. Эта систематика - иерархическая, самой крупной классификационной единицей ее является царство.
Царство минералов - совокупность (или множество) природных химических веществ, обладающих определенной конституцией. Этим царство минералов вычленяется из другого, более обширного множества - множества неорганических химических веществ.
А далее изобразим деление схемой:
Мы видим, что самой крупной единицей после разделения на подцарства является тип. В подцарстве простых веществ тип только один, а в подцарстве соединений их 4. Выделяются они по типу химической связи.
I тип. Минералы, в основе которых лежит атомная структура; структурными единицами являются атомы. Связь в этом случае либо металлическая (она будет гомодесмическая), либо ковалентная + остаточная (т.е. гетеродесмическая) - самородная сера (!).
II тип. Соединения преимущественно с ионно-ковалентным типом связи с преобладанием ковалентной составляющей (хотя условно мы обозначаем их как ионные соединения).
Рекомендуемые материалы
III тип. Окислы и гидроокислы характеризуются тоже ионно-ковалентным типом связи, но с усилением степени ионности.
IV тип. Гетеродесмическая связь. Ковалентная внутри радикалов и ионно-ковалентная между радикалами и катионами.
V тип. Галогенные соединения. Преимущественно ионная связь.
Выделение таксона класс основывается на более узком наборе химических свойств и типов связи. В подцарстве соединений выделение классов основывается на том, какой элемент является анионом или анионообразователем (в сложных анионах). Т.е. химизм начинает выдвигаться на первый план. В пределах типа классы располагаются по мере возрастания силы аниона.
А как идет деление дальше?
Класс По элементу-анионообразователю.
Подкласс Тип аниона - сложный, простой, с дополнительными анионами, с кристаллизационной водой. Пример: Класс сульфидов - подклассы низших сульфидов, персульфидов, сульфосолей.
Надотдел Дополнительное деление по типам анионов - моноанионные, полианионные...
Отдел По основному типу структуры - координационная, цепочечная, островная...
Подотдел По характеру подчиненного структурного мотива. Пример: островные делятся на субцепочечные и субслоистые.
Ряд химический тип соли: кислые ,средние, основные, кристаллогидраты., с дополнительными анионами и т.п.
Группа Однотипный состав и структура, полиморфные модификации.
Подгруппа Однотипный состав и аналогичная структура (часто - разделение полиморфных модификаций).
Род В случае образования непрерывных твердых растворов, например род оливина, род турмалина, род блеклых руд.
Несколько групп или родов, минералы которых близки по составу и структуре и отличаются лишь особенностями , могут объединяться в семейства - промежуточный, более крупный таксон по отношению к роду и группе, например. сем. пироксенов, сем. платиноидов. Наконец, в пределах группы или рода выделяют минеральный вид, принципы выделения которого рассмотрены в первой лекции - постоянство структуры и непрерывность состава. Наименьший таксон - минерал - крайние члены изоморфных рядов - меньше которого могут быть только разновидности.
Подцарство простых (элементарных) веществ.
В самородном состоянии известно нахождение около 20 элементов. Это металлы: Cu, Ag, Au; Fe, Co, Ni; Ru, Ry, Pd, Os, Ir, Pt; полуметаллы As, Sb, Bi и неметаллы S, Se, Te. Проблематично нахождение в самородном состоянии Al и Si, отмечены находки Pb, Sn, Zn, известна в самородном состоянии Hg.
Большинство из них встречается очень редко и в очень малых количествах ‑ на долю самородных веществ в земной коре приходится лишь около 0,1% массы последней. При этом Fe, Co, Ni на земле в самородном состоянии чаще всего оказываются космического происхождения. Тем не менее, для ряда элементов самородное состояние является главным, и именно в таком виде они образуют промышленные концентрации.
Это Au, Ag, Cu; Pt, Ir, Os, Bi, S, C.
По устойчивости среди самородных веществ различают:
1) Элементарные вещества, для которых самородное состояние является наиболее устойчивым, и они в нем наиболее часто пребывают. Это Au, Pt и все платиноиды.
2) Элементарные вещества, для которых самородное состояние ‑ временное и притом неустойчивое, т.к. по химической своей природе они легко образуют химические соединения. Это Сu, Fe, Ni; As, Sb, Bi.
3) Элементарные вещества. для которых самородное состояние временно, но в определенных условиях они в нем устойчивы и могут пребывать длительное время. Это типичные неметаллы S и C.
Что в целом характерно для самородных веществ в химическом и структурном отношении? В отношении химизма ‑ широкое проявление изоморфизма ‑ образование твердых растворов, которые в применении к металлам принято называть природными сплавами, хотя образуются они отнюдь не всегда при плавлении.
Например, электрум Au ‑ Ag, поликсен Pt‑Fe, осмистый иридий Os‑Ir.
В структурном отношении для простых веществ характерен полиморфизм.
Генезис.
1.Магматический ‑ Pt, Fe, C (алмаз, графит) - прямая кристаллизация из расплава.
2.Пегматитовый ‑ тот же графит.
3.Гидротермальный ‑ Au, Ag, Bi, As.
4.Экзогенный:
а) Распад сложных соединений: Cu2S (халькозин) ‑ Cu ‑ Cu2O (куприт); образование самородной ртути при разложении ртутистой блеклой руды.
б) Биогенное образование ‑ за счет разложения сульфидов и сульфатов бактериями ‑ образование самородной серы.
5.Метаморфический ‑ за счет углеводородов органики в процессах восстановления, за счет карбонатов ‑ образование графита.
Разделение простых веществ на классы производится по характеру связи, т.е. по типу кристаллической решетки. Выделяют два класса: 1) класс металлов и 2) класс неметаллов.
Класс 1.1. Самородные металлы.
Химизм. Металлы, встречающиеся в самородном состоянии. выше перечислены. Это, во-первых, Au и платиноиды (Pt, Pd,I r, Os, Rh, Ru), встречающиеся главным образом в самородном виде, во-вторых, обычные, но неустойчивые в самородном состоянии Ag и Cu, и в-третьих ‑ минералы семейства Fe ‑ в виде крупных самородков в основном космического происхождения. Крайне редко в специфических условиях восстановительной среды возникают Zn, Sn, Pb, Al, Hg, Cd, In.
Характерной особенностью самородных металлов является неоднородность состава. Это связано как раз с широким проявлением изоморфизма. По характеру изоморфизма можно выделить
а)Непрерывные ряды (сплавы):
1)(Pt, Fe) ‑ поликсен.
2)(Ir, Rh, Pt) ‑ от самородного Ir до иридистого Rh и платины.
3)(Pt, Pd) ‑ от палладистой платины до платинистого палладия.
4)(Cu, Ag) ‑ от серебристой меди до медистого серебра.
5(Au, Ag) ‑ электрум.
б) Широко распространены ограниченные твердые растворы, что связано с различием кристаллической структуры крайних членов изоморфных рядов:
1) (Fe,Ni) ‑ (Ni,Fe) ‑ никелистое железо ‑ железистый никель.
2) (Os,Ir) ‑ (Ir,Os) ‑ иридосмин ‑ осмирид.
3) (Au,Cu) ‑ медистое золото.
4) (Ag,Hg) ‑ ртутистое серебро.
5) (Au,Hg) ‑ ртутистое золото.
В последних трех случаях говорят о направленном или полярном изоморфизме: изоморфное замещение идет лишь в одну сторону ‑ медь входит в решетку золота (медистое золото), но золото не накапливается в самородной меди, и золотистая медь не образуется. Обратим внимание как формируются названия минералов: примесь, стоящая в скобках формулы после главного компонента, в названии минерала дается как прилагательное.
в) При распаде пересыщенных твердых растворов могут возникать интерметаллические соединения ‑ члены изоморфных рядов, с соотношением компонентов, близким к стехиометрическому.
Например: Cu3Au2 ‑ купроаурид, Au2Hg2 ‑ амальгама золота, Ni3Fe ‑ аваруит, CoFe ‑ уайрауид , и др.
Структура самородных металлов определяется металлической связью, когда положительные остовы металла погружены в обобществленный электронный газ. Такая связь может рассматриваться как ненаправленная. Но это лишь упрощенная модель, при более строгом рассмотрении металлическая связь оказывается частично направленной за счет гибридизации орбиталей соседних частиц. Более того, у некоторых металлов появляется ковалентная составляющая связи ‑ как это имеет место у Ru, Os, Rh и Ir. Поэтому, хотя формально структуры самородных металлов в большинстве своем описываются как плотнейшие упаковки (ПУ), природа их различна, и это имеет свое проявление в свойствах. Помимо плотнейших упаковок среди структур металлов имеют место также плотные, но не плотнейшие структуры типа ОЦК-П- как, например, для самородного железа.
Как же проявляются особенности связи и структур?
При общем для всех самородных металлов металлическом блеске (наличие свободных электронов!), высокой тепло- и электропроводности, общей высокой плотности (поскольку все самородные металлы - элементы с высоким атомным номером Z, а структуры - плотные), они существенно различаются по температуре плавления. У платиноидов, из - за более прочной связи в структуре (ковалентная составляющая!) - температура плавления наиболее высокая, и это находит свое отражение в генезисе: платиноиды образуются с наиболее высокотемпературными ультраосновными породами, и у них резко повышается твердость (до 7 у Ru, Rh, Os, Ir, и появляются хрупкость и спайность до совершенной, а это указывает на анизотропию связи в структуре!), в противовес более мягким и ковким металлам, не имеющим ковалентной компоненты связи (aFe, Ni, Pt, Pd).
Генезис.
1. Магматический - Pt, Fe.
2. Гидротермальный - Au, Ag.
И в первом , и во втором случае особое значение имеют восстановительные процессы:
1) Fe - в базальтах - за счет восстановления сульфидов (пирротина) углеродом магмы;
2) Ag - в гидротермальном образовании - за счет восстановления соединений серебра при образовании арсенидов Co, Ni, Fe.
3. Экзогенное образование - в зонах окисления, при электрохимическом восстановлении сульфидов по схеме: MeS + 2e ® Me + S-2 (например, Cu, Ag).
Изменение: В поверхностных условиях ряд металлов устойчив, поэтому некоторые из них накапливаются в россыпях, причем нередко с очисткой и образованием промышленного типа. Это Pt, Au.
В метаморфическом процессе некоторые самородные металлы также устойчивы, более того, зерна их способны перекристаллизовываться и укрупняться с образованием промышленных концентраций, примером могут служить золотоносные метаморфизованные конгломераты Витватерсранда (ЮАР).
Химически активные металлы на поверхности вступают в соединения и не сохраняются.
Систематика класса самородных металлов
1. Семейство самородного железа
2. Семейство платиноидов
3. Группа самородной меди
Семейство самородного железа
1. Группа самородного железа
феррит ( до 3 ат. % Ni)
камасит (до 5,5 ат. % Ni)
2. Группа самородного никеля
тэнит (27-65 ат. % Ni),
(аваруит) Ni3Fe (62,5-92 ат. % Ni)
самородный никель - (Ni, Fe)
Структура. Все минералы семейства - кубические, но для группы самородного железа характерна структура ОЦК-II с симметрией Im3m, а для группы самородного никеля - ПКУ (Fm3M).
Генезис.
1. Космическое (метеоритное) происхождение.
2. Земное (теллурическое) происхождение.
а) Магматический генезис:
Образование минералов семейства самородного Fe чаще связано с субвулканическими базальтоидами - при восстановлении железа железосодержащих минералов углеродом магмы или попадающих в нее углеродистых вмещающих пород (углистых сланцев, битумов), либо - за счет разложения карбонильных комплексов:
Fe(CO3)n ® a-Fe + графит + когенит Fe3C.
б) Экзогенное образование - при восстановлении Fe из растворов в резко восстановительной среде (болотные руды, угли, песчаники).
Группа самородной меди
Самородные медь - Cu, серебро - Ag, золото - Au.
Все три минеральных вида имеют структуру ПКУ, и, т.к. впервые эта структура определялась для самородной меди, то затем все аналогичные структуры стали называть "ПКУ типа меди". Из трех минералов медь является наиболее чистым, наиболее богато примесями самородное золото, это в значительной мере определяется особенностями генезиса.
Самородная медь
Химизм. Наиболее чистой является так называемая "вторичная" медь, образующаяся при разложении других медьсодержащих минералов. Первичная медь может содержать примеси Zn, Ag, Au и Fe.
Для диагностики очень важно присутствие вторичных медных минералов: синего азурита Cu3(CO3)2(OH)2, зеленого малахита Cu2(CO3)(OH)2, красного куприта Cu2O.
Похожие по цвету - никелин (Н=5-5,5); борнит (Н=3, побежалость).
Генезис. Cu - элемент химически активный, поэтому, чтобы образовалась самородная медь, необходимым общим условием является восстановительный характер среды. Где же реализуются такие условия?
I. В эндогенных процессах - "первичная медь".
1.В некоторых магматических образованиях - шарики и включения самородной меди в диабазах и вулканических стеклах.
2. При низкотемпературной гидротермальной деятельности в связи с метаморфизмом базальтоидов - миндалины, цемент между минералами в этих миндалинах, встречается в секущих базальтоиды кальцитовых жилках. Ассоциация низкотемпературных гидротермальных минералов: эпидот, кальцит, цеолиты, пренит, причем медь часто тонко диспергирована в этих минералах и окрашивает их в розовый цвет (пренит, цеолиты). Из наиболее известных месторождений такого типа - США, оз. Верхнее.
II. В экзогенных (гипергенных) процессах - "вторичная медь".
1. Образование в зоне окисления за счет первичных медных минералов.
Cu2S+O2 ® CuSO4+Cuо; CuSO4 + 2FeSO4 ® Fe2(SO4)3+Cuо
В целом для зон окисления характерна ассоциация самородной меди с халькозином, купритом, малахитом, азуритом, хризоколлой, лимонитом.
2. В аридных областях самородная медь осаждается из медьсодержащих поверхностных растворов или из очень низкотемпературных гидротермальных растворов:
а) в медистых песчаниках (Джезказган, Казахстан);
б) в медистых торфяниках (в восстановительной обстановке) - Екатеринбургская обл.
Применение. В практическом отношении наиболее важными являются месторождения меди в зонах окисления, имеет значение и низкотемпературный гидротермальный тип - как у оз. Верхнего. Главный потребитель - электротехническая промышленность. Сплавы: бронза - сплав (Cu,Sn), латунь - (Сu,Zn), мельхиор - (Cu,Ni).
Cамородное серебро.
Название - от санскритского "аргента" - светлый.
Химизм. Всегда с примесями: Au (иногда значительное количество, вплоть до образования интерметаллида кюстелита Ag3Au); Hg, Bi, Sb. Поскольку существует непрерывный ряд смесимости Ag-Au, то выделяют еще и промежуточный член - минерал электрум с примерно равным количеством Ag и Au.
Морфология: дендриты, пластины. проволочки, самородки.
Свойства: Серебристо- (или серебряно-) белый цвет, металлический блеск. Но серебряно-белым бывает лишь в свежем изломе, обычно же - желтоватое, буроватое - за счет пленок AgCl, AgBr, AgJ, до черного - за счет пленок акантита Ag2S. Ковкое, а потому излом крючковатый. Н=2.5 (в отличие от платины), d=10 -11 (опять-таки - ниже чем у Pt)
Генезис. I. Эндогенное образование. Магматического генезиса нет - только гидротермальный. Это связано с тем, что серебро - химически активный элемент, и для его выделения в самородном виде непременно нужны восстановители, а они характерны именно для гидротермального процесса. Это могут быть арсениды Co, Ni, Fe и тогда идут реакции типа:
2NiAs+2Ag+ Þ 2Ag + NiAs2+Ni, либо это может быть органика или Fe+2. В зависимости от источника гидротермальных растворов выделяются:
1. Плутоногенные образования. Это среднетемпературная гидротермальная минерализация следующих типов:
а) Пятиметальная формация (Ag, Co, Ni, Bi, U) - главные нерудные минералы не кварц, а карбонаты - кальцит, сидерит, анкерит, доломит. Рудная ассоциация: минералы серебра - самородное серебро, аргентит, сульфосоли серебра; арсениды Co, Ni, (Fe) - шмальтин, саффлорит, никелин; самородный висмут и висмутин; урановая смолка (уранинит). Это очень важный в промышленном отношении тип, и классическим выражением его являются месторождения Рудных гор - на границе Чехии и Германии - Шнееберг, Аннаберг (ФРГ), Яхимов (Чехия). Для этого типа характерно восстановление серебра арсенидами и именно отсюда известны наиболее крупные выделения самородного серебра - в Шнееберге выделения серебра совместно с аргентитом достигали 40 т.
К этой же формации, но с неполным перечнем элементов, относятся район Кобальт провинции Онтарио в Канаде, где мало U, и район Большого Медвежьего озера (Канада), где урановая минерализация преобладает. Именно в районе Кобальт был обнаружен знаменитый "серебряный тротуар" - пластина длиной около 30 м, весившая почти 20 т, другая пластина самородного серебра весом в 612кг установлена в парламенте Канады.
б) Благородная серебряная (кальцитовая) формация: кальцитовые жилы с серебром, аргентитом и незначительным количеством других сульфидов и арсенидов Co, Ni, (Fe). Это знаменитое месторождение Консберг (Норвегия), давшее лучшие образцы проволочного серебра; Фрайберг и Андреасберг (ФРГ).
Есть еще несколько типов, но они в целом носят подчиненный характер.
2. Вулканогенные гидротермальные образования (связанные с близповерхностными, вулканическими и субвулканическими магматическими очагами, и потому локализованные в районах молодого вулканизма) - низкотемпературные образования. Это месторождения Кордильер, Японии, Новой Зеландии, Карпат. В Кордильерах они прослеживаются на территории разных стран - от западных штатов США через Мексику (м-е Пачука), Чили, Перу, Боливию (Потоси) до Аргентины. (Само название страны - Аргентина - и название района и реки - Ла Плата, что значит "серебряная", - говорят о богатстве региона).
II. Экзогенное образование. Восстановление серебра до самородного состояния в этом случае идет в результате электрохимических реакций в зоне окисления серебряных и серебросодержащих месторождений. Это либо так называемые "железные шляпы", где серебро ассоциирует с лимонитом, а в засушливых районах - и с галогенидами серебра; либо это зоны вторичного сульфидного обогащения (зоны цементации) - здесь серебро находится в ассоциации с халькозином, галенитом. Месторождений много - Урал, Рудный Алтай, Салаир, Забайкалье и др.
Изменение. В поверхностных условиях самородное серебро неустойчиво и замещается акантитом Ag2S, в условиях сухого климата - галогенидами серебра.
Применение. Ювелирный материал; приборы, в которых нужна максимальная электропроводность - серебро обладает наивысшей электропроводностью, принимаемой за 100%, широко применяется в сплавах. Издавна служило денежным эквивалентом - в частности, и на Руси в ХIII в. "рубль" означал рубленный брусок серебра весом в 200 г. В медицине используется обеззараживающее действие серебра.
Cамородное золото
Химизм. Из минералов группы самородное золото ‑ наименее чистый минерал; в качестве наиболее частых примесей - Pd, Cu, Bi. Pd; Cu - для золота г. Карабаш (Челябинская обл.). Но самая частая и наибольшая по количеству примесь - это, конечно, Ag: до 4-15%, что связано с близостью атомных радиусов Ag и Au: у обоих он близок к 1.44А, в то время как у Cu r =1.27А, а у Pd r =0,68А. Более того, именно по этой причине существует непрерывный ряд смесимости Au-Ag, и в промежуточном члене - электруме - содержание серебра составляет 25 ‑45%. Наиболее чистым является золото, переотложенное в поверхностных условиях, когда оно очищается от всяких примесей.
Морфология. Кристаллы золота редки, в огранке их - (111), (110) с гранками (100). Более обычны скелетообразные дендритные формы, зерна, чешуйки, листочки и пленочки; вторичное золото дает губчатые выделения или бывает порошковатым ("горчичное золото"). Наиболее крупные золотые самородки известны из россыпей Чили (153 кг), Австралии (93,5 кг). На Урале в 1842 г. был найден самородок весом до 36 кг, а в 30-х годах этого века ‑ самородки в 19 и 20 кг.
Свойства и диагностика. Золото имеет характерный золото-желтый цвет, не меняющийся на старом изломе. От примесей цвет может меняться: Cu - красноватый оттенок ("червоное золото"), с Ag - светло-желтый, электрум - до белого; "горчичное золото" ‑ буроватое, цвета сухой горчицы. Похожие пирит и халькопирит хрупки, твердость их выше, и цвет отличен на старом и свежем изломе. Золото отличается также высокой химической устойчивостью - в отличие от сульфидов не растворяется в HCl. Растворяется в царской водке и дает амальгамы с жидкой ртутью.
Генезис.
I. Эндогенное образование.
1. В магматических породах разного состава золото находится в рассеянном состоянии и примышленных скоплений не дает. Концентрируется оно в результате извлечения из магматических пород при их последующем изменении и переносится гидротермальными растворами в виде хлоридных комплексов. Разложение этих комплексов за счет реакции диспропорционирования при понижении температуры и приводит к отложению самородного золота:
2[Au+1Cl2]-1 Þ 3Auо + [Au+4Cl4]-1
Поэтому наиболее важным для самородного золота является гидротермальное образование. Здесь различают следующие случаи:
А. Отложение золота в скарнах. Здесь золото первоначально бывает растворено в сульфидах, а потому появляется в скарнах с наложенной сульфидной минерализацией. Хорошим примером могут служить золоторудные гранат-волластонитовые (иногда тремолитовые) скарны Горной Шории, в которых золото связано с наложением кварц-борнит-халькозиновой минерализации.
Б. Собственно гидротермальные жилы. В зависимости от источника гидротермальных растворов, условий формирования жил и Т образования различают:
а) Плутоногенные ‑ связанные с крупными массивами гранитоидных пород, кристаллизовавшихся на глубине.
Это высоко- и преимущественно среднетемпературные образования. Для них в целом характерно образование жил, штокверков, зон окварцевания в метаморфических и магматических породах. Кварц здесь крупнозернистый, из нерудных встречаются также турмалин, барит, карбонаты; рудная ассоциация - пирит, арсенопирит, блеклые руды, борнит; в некоторых месторождениях это галенит со сфалеритом. Золото образует чешуйки, зерна, включения в сульфидах, встречается в самородках. Это месторождения Урала (Березовское), Казахстана (Степняк), Аляски; система жил Мазер-Лод (Калифорния) протяженностью до 200 км, при мощности жил от 2 до 20 м.
б) Вулканогенные ‑ связанные с гидротермами, источником которых являются близповерхностные магматические очаги. Образование таких жил идет также на небольшой глубине от поверхности, и поэтому это средне- и преимущественно низкотемпературные жилы.
Они характеризуются тонкозернистым или даже халцедоновидным кварцем и тонкодисперсным, часто макроскопически невидимым, золотом в этом кварце (желтый плотный тонкозернистый кварц Балея в Читинской обл.!). Помимо кварца - жильные минералы: карбонаты - кальцит, сидерит, родохрозит; барит, флюорит. Рудные: пирит, арсенопирит, блеклые руды, теллуриды золота и иногда - как на том же Балее - типичный для низкотемпературной ассоциации антимонит. Примеры: Пачука (Мексика), Япония, Румыния. (Что их объединяет? Это всё районы развития молодого вулканизма, не удивительно, что и месторождения здесь вулканогенные).
II. Экзогенный тип месторождений золота. За счет высокой плотности и химической стойкости золото способно накапливаться в россыпях. Это могут быть россыпи элювиальные (Австралия), русловые (Алдан, Колыма, Аляска, Калифорния), террасовые (Алдан, Лена, Охотское побережье), морские (Аляска). Но золото не просто накапливается в россыпях ‑ в гипергенных условиях оно может электрохимически растворяться ( в паре Ag-Au) и тут же переотлагаться; или в присутствии гумусового вещества переходить в коллоидные растворы, перемещаться и отлагаться при очень низких температурах ‑ известны просечки золота в ледяных жилах! ‑ и это означает, что экзогенные концентрации золота тоже могут рассматриваться как генетический тип. Именно очистка золота от примесей в результате экзогенного переотложения в россыпях приводит к увеличению его пробности.
III. При метаморфизме самородное золото устойчиво, процессы метаморфизма ведут к его перекристаллизации и укрупнению, сегрегации во вмещающих породах, и именно к этому типу относятся знаменитые метаморфизованные конгломераты Витватерсранда (Юж. Африка), в которых, помимо золота, присутствуют уран и платиноиды. Близкими по типу образования являются проявления золота на Енисейском кряже.
Применение. Золото ‑ основной валютный металл; "царь металлов и металл царей" ‑ дорогой ювелирный материал. Но оно еще и очень тонко работающий металл, поскольку применяется в электронике, в сплавах с платиноидами используется в оборудовании для производства синтетического волокна, в зубоврачебной практике.
Класс 1.2. Неметаллы и полуметаллы.
Систематика.
1. Гр. самородной серы -
Сера ромбическая S.
2. Гр. самородного селена -
Селен Se,
Теллур Te.
3. Гр. самородного мышьяка -
мышьяк As,
сурьма Sb,
висмут Bi.
4. Гр. самородного углерода -
подгруппа графита,
графит С,
подгруппа алмаза,
алмаз С,
подгруппа лонсдейлиита,
лонсдейлиит С.
Как видим, в этом классе объединены типичные неметаллы ‑ S, Se, C ‑ с минералами, которые всегда рассматривались как полуметаллы ‑ As, Sb, Bi ‑ и обычно объединялись в одном классе с металлами. Мы тоже будем характеризовать их как полуметаллы, но помнить. что они все-таки не металлы, а потому и относить к классу неметаллов. Вспомним: все самородные металлы характеризовались металлической связью ‑ это их определение. У полуметаллов связь в структуре ковалентно-металлическая, да еще и молекулярная, а ковалентная и молекулярная связь характерны как раз для неметаллов. Это структурное основание для такого отнесения. Теперь посмотрим на химизм. Все неметаллы способны быть анионообразователями ‑ мы знаем сульфиды, сульфаты, карбонаты; но точно так же анионообразователями могут быть полуметаллы ‑ мы знаем арсениды и арсенаты, антимониды (стибниды), висмутиды. Значит, и по химизму есть все основания объединять полуметаллы именно с неметаллами.
В этом классе мы рассмотрим группы мышьяка, серы и углерода, начав как раз с полуметаллов, чтобы иметь возможность подчеркнуть их сходство и различия с предыдущим классом металлов.
Гр. самородного мышьяка.
Самородные As, Sb, Bi.
Известно что в этом ряду металлические свойства усиливаются от As к Bi, и поэтому именно самородный висмут наиболее близок к настоящим металлам, и он же из трех ‑ наиболее распространен: если самородные мышьяк и сурьма известны лишь как минералогические находки, то самородный висмут образует промышленные концентрации. Поэтому всю группу мы будем характеризовать на его примере.
Химизм. Самородный висмут ‑ минерал довольно чистый, лишь как следы в нем отмечаются Fe, As, Sb, S.
Структура. Ее можно рассматривать как структуру NaCl, в которой все позиции занимает Bi, и которая сжата вдоль L3 так, что плоские сетки оказываются попарно сближенными. Вследствие такой деформации кубическая структура NaCl преобразуется в тригональную - L3 куба становится L3 ромбоэдра. При этом меняется координационное число: вместо 6, как это было у частиц в NaCl, координация Bi снижается до 3 - три более короткие связи к частицам в соседней, составляющей пару, сетке имеют расстояние в 3,10А, в то время как расстояние до частиц в другой паре сеток составляет 3,47А. (См. рисунок.)
Меняется и характер связи ‑ она становится ковалентно-металлической в паре сеток и молекулярной между парами. Следствием такой неоднородности связи вдоль L3 будет появление совершенной спайности параллельно (0001).
Морфология. Обычны же два морфологических типа: (а) округлые каплевидные выделения и изометричные зерна, и (б) пластинчатые выделения, перистые дендриты. Соответственно агрегаты - зернистые и листоватые.
Свойства и диагностика. Цвет в свежем изломе серебристо-белый с розоватым или желтоватым оттенком, но быстро развивающаяся красноватая побежалость часто его маскирует. Блеск металлический, и это как раз и роднит самородный висмут с металлами. Н=2-2,5; d=9,8. Сп. сов. по {0001}, средняя по {202,-1}, кроме того, в результате полисинтетического двойникования иногда появляется отдельность по {101,-2}. Температура плавления 273оС, диамагнетик. Диагностическими являются низкая твердость, высокая плотность, цвет и спайность.
В начале курса студенты обычно путают его с никелином и самородной медью, принимая красноватую побежалость за истинный цвет. Но у никелина гораздо выше твердость и нет спайности; у меди, близкой по твердости, спайность тоже отсутствует.
Генезис. Образование самородного висмута определяется с одной стороны температурой плавления, а с другой ‑ щелочностью растворов и активностью S. Очень важно, что висмут как элемент имеет четкую геохимическую специфику ‑ его генетические типы связаны с кислым магматизмом.
I. Высокотемпературные генетические типы:
а) гранитные пегматиты,
б) грейзены,
в) высокотемпературный гидротермальный генезис ‑ жилы, связанные с грейзенами (кварц-касситеритовые, кварц-вольфрамитовые), или гидротермальное наложение в скарнах.
Именно в этих типах решающее значение имеет температура плавления висмута - в пегматитовом расплаве или в высокотемпературных гидротермах при температурах выше 270о висмут образует капли или выполняет пространство между ранее кристаллизовавшимися, более высокотемпературными минералами. Затем, по достижении температуры плавления и ниже, эти капли, сохраняя внешнюю форму, кристаллизуются ‑ получаются округлые каплеобразные выделения. Именно такой высокотемпературный висмут известен в пегматитах Казахстана (Караоба), в грейзенах Шерловой горы и в связанных с грейзенами кварц-вольфрамитовых жилах м-я Букука (Забайкалье), в скарнах Лянгара (Узбекистан).
II. Гидротермальное образование из гидротерм, температура которых ниже температуры плавления висмута ‑ преимущественно среднетемпературный гидротермальный генезис.
а) Пятиметальная (в т.ч. кобальт-никель-арсенидная) формация. См. серебро.
Самородный висмут здесь ассоциирует с арсенидами Co, Ni, Fe и образует в срастании с ними копьевидные, перистые дендриты либо тончайшие прожилки (Рудные горы, Чехия; Кобальт, Онтарио; Асхатиин-Гол, Тува).
б) Вулканогенные гидротермальные образования.
Образование самородного висмута в гидротермальной среде в сильной мере зависит от щелочности растворов и активности S: при низкой активности S в щелочной среде образуется самородный висмут, при повышении активности серы вместо висмута образуется висмутин Bi2S3, точно также висмут замещается висмутином в нейтральных растворах. Поэтому для самородного висмута характерна ассоциация с пирротином, а для висмутина ‑ с пиритом.
III. Высокая плотность самородного висмута позволяет ему накапливаться в россыпях.
Изменение. На поверхности при окислении по самородному висмуту образуется бисмит Bi2O3, образующий желтые охры, и бисмутит Bi2[CO3](OH)4 ‑ тоже белые и желтые охры.
Применение. Висмут широко применяется в металлургии, фармацевтике, химической промышленности, ядерной технике и электронике. Это прежде всего легкоплавкие сплавы на висмутовой основе (сплав Вуда содержит 44-57% Bi, 25-28% Pb, ~13% Sn, 6-14% Cd и имеет температуру плавления ~70оС; используется в предохранителях). Сплавы Вi при низкой температуре обладают сверхпроводимостью, а некоторые из них обладают уникальными магнитными свойствами и используются в быстродействующих усилителях и выключателях. Bi2O3 ‑ катализатор в производстве полимеров, используется также в производстве эмалей, фарфора и стекла как флюс, понижающий температуру плавления. Висмут только бериллию уступает по рассеянию тепловых нейтронов, почти не поглощая их, и потому используется как теплоноситель и охлаждающий агент в ядерных реакторах. Наконец, еще с эпохи Возрождения висмут используется в фармацевтике и косметике ‑ знаменитые "испанские белила", перламутровая губная помада.
О других членах этой группы. Самородные мышьяк и сурьма известны в небольшом количестве в м-ниях пятиметальной формации, полиметаллических м-ниях, образуя прожилки, почкообразные скопления; иногда встречаются в россыпях.
Группа самородной серы.
Сера ‑ вещество полиморфное. Ромбическая модификация Fddd устойчива ниже 95,6оС, выше этой температуры она переходит в моноклинную. Природная самородная сера как раз представляет собой ромбическую модификацию.
Структура самородной серы ‑ кольцевая молекулярная. Кольцевые молекулы S8 можно представить как двухслойные квадраты, так что атомы серы располагаются на двух уровнях, при этом квадраты повернуты друг к другу на 45о (рисунок). При таком строении молекулы каждый атом S имеет КЧ=2. Связь в молекуле ковалентная, а между молекулами - слабая, молекулярная. В элементарной ячейке располагается 16 таких колец: по вершинам ромбической ячейки, в центрах боковых граней и в четырех из восьми октантов. При этом кольца располагаются различно, но плоскости квадратных колец параллельны оси С (рисунок).
Химизм. Природная сера обычно чистая, в качестве примеси характерен Se, встречаются механические примеси органики, сульфидов.
Морфология. Бипирамидальные, таблитчатые кристаллы, тонкозернистые выделения и сплошные массы, в вулканических областях ‑ потоки, скопления коллоидальных шариков (сульфурит), серный песок, дендриты (в фумаролах).
Свойства - смотрели на семинарах. Спутать кристаллическую серу с чем-либо трудно, особенно учитывая специфику ее генезиса, тем не менее студенты иногда принимают за самородную серу клейофан (у него выше твердость, спайность).
Генезис. I. Вулканогенное образование.
а) В эксгаляциях ‑ фумарольно-сольфатарный тип.
1.Из паров S.
2.При неполном окислении H2S:
2H2S+O2 Þ 2S¯+2H2O,
2H2S+SO2 Þ3S¯+2H2O.
Ассоциация - нашатырь, реальгар, аурипигмент; форма выделения ‑ дендриты, при подводных фумаролах ‑ серный песок (вулканы Камчатки, Курил, Японии).
б) Сернокислые гидротермы, воздействующие на вмещающие породы, вызывают осернение, алунитизацию, опализацию, каолинизацию; все эти процесс сопровождаются отложением серы и сульфидов железа (марказит).
в) Потоки серы возникают либо при переплавлении серы за счет тепла при новой активизации вулканической деятельности, либо при пожарах на серных пляжах в кальдерах вулканов. Очень часто сера в таких потоках бывает насыщена вулканическим пеплом и приобретает зеленовато -серый, темно-серый цвет.
II. Зоны окисления сульфидных месторождений.
В результате окисления сульфидов в зоне окисления образуется H2SO4. Взаимодействие серной кислоты с сульфидами ведет к образованию H2S. При неполном окислении сероводорода так же, как и в эксгаляциях, отлагается самородная сера. Кроме того она может быть промежуточным продуктом реакций типа:
FeS2+Fe2(SO4)3 Þ 3FeSO4+2S¯
Ш. Биогенное (биохимическое) образование, связанное с жизнедеятельностью бактерий. Этот генетический тип локализуется в осадочных породах. Здесь может реализоваться несколько механизмов.
а) Эпигенетические шляпы соляных куполов.
б) Эпигенетический инфильтрационный.
В обоих случаях при просачивании растворов через гипс-ангидритовую породу (в соляных куполах это образующиеся при растворении солей гипс-ангидритовые шляпы) ‑ растворы обогащаются сульфатами; сульфат-редуцирующие анаэробные бактерии восстанавливают сульфаты до H2S. При попадании этих содержащих H2S вод в зоны смешения с поверхностными, богатыми кислородом, водами происходит окисление сероводорода с образованием серы; либо такое же окисление происходит в результате деятельности аэробных бактерий. Эти процессы идут в трещинных зонах, новообразованная сера образует кристаллы в полостях. Именно к такого типа образованиям в трещинных зонах относятся месторождения серы Шор-Су (Узбекистан) и Гаурдак (Туркмения), где кристаллы самородной серы ассоциируют с целестином, гипсом, кальцитом.
в) Сингенетическое осадочное образование. Образование серы идет в лагунах и озерах, где отлагаются гипс или ангидрит. В придонной части, богатой органикой, под влиянием анаэробных бактерий эти сульфаты восстанавливаются с образованием сероводорода и карбоната кальция. Образовавшийся сероводород поднимается вверх и окисляется либо кислородом, либо аэробными бактериями с образованием серы, которая оседает на дно, смешиваясь с кальцитом. Месторождения в этих случаях представляют собой переслаивания гипсовых пород и карбонатных, содержащих серу. Кроме серы в ассоциации с кальцитом будут также целестин, барит. Примером могут служить месторождения Среднего Поволжья, Предкарпатья (Украина, Польша), Сицилии.
Изменение. Самородная сера в поверхностных условиях может окисляться до серной кислоты и сульфатов.
Применение. H2SO4, сельское хозяйство, резина, спички, краски.
Группа самородного углерода.
Подгруппа графита.
Графит.С.
Химизм. Графит обычно минерал не чистый - всегда содержит механические примеси.
Структура слоистая: сетки из правильных шестиугольных колец образуют слои, расстояние между которыми вдвое больше, чем между частицами в слое (рис.). Для каждого атома углерода КЧ=3. Слои смещены относительно друг друга ‑ в каждом следующем слое узлы решетки располагаются под центрами шестиугольников предыдущего.
При этом возможны различные случаи смещения слоев ‑ т.е. структура графита обладает политипией: возможно повторение положения первого слоя третьим слоем, тогда говорят о двухслойном чередовании, структура будет гексагональной P63/mmc и обозначается 2Н (двойка - число слоев, участвующих в повторении, Н ‑ гексагональная от "hexagon"); либо повторение положения первого слоя наступит лишь в четвертом слое ‑ если третий слой повернут относительно первого на 180о. В этом случае говорят о трехслойном чередовании, структура будет тригональной и обозначается 3R (3 ‑ число слоев, участвующих в повторении, R ‑ означает "rombohedron", т.е. тригональная). Поскольку слои разделены большим расстоянием, связь внутри слоя и между слоями оказывается различной: внутри слоя ковалентная с долей металлической, (при этом возможны свободные электроны!), между слоями ‑ остаточная. Это позволяет рассматривать слой как двухмерную молекулу и относить графит к молекулярным соединениям.
Тонкие структурные исследования показали, что слои могут быть не только плоскими, но и волнисто изогнутыми, и это делает их подобными структурным слоям углерода в алмазе.
Наиболее распространен политип 2Н, поэтому в целом для графита принимают симметрию P63/mmc.
Морфология. В соответствии со структурой ‑ кристаллы таблитчатые гексагональные; отдельные кристаллы редки, обычны розетки, шарики, сплошные чешуйчатые или скрыточешуйчатые агрегаты. Тонкодисперсный графит в аморфном углеродистом веществе (антраксолите), образующийся при метаморфизме за счет антрацитоподобного битума, называется шунгит.
Свойства и диагностика. Кроме отмеченных на семинаре - минерал электропроводный (металлическая составляющая связи в молекуле!). Черта графита знакома каждому, писавшему мягким простым карандашом., и именно по черте графит отличают от очень похожего на него молибденита ‑ у молибденита при растирании черты появляется зеленоватый оттенок.
Генезис. Выделение углерода в виде графита требует высокой температуры, хотя давление не обязательно высокое. Это возможно в следующих случаях:
а). При разложении летучих ‑ СО, СН4; карбонатов ‑ сидерита, доломита.
б). При пиролизе (сухой перегонке) угля.
в). При отделении углерода, растворенного в магме. Следовательно, можно выделить следующие генетические типы:
1. Магматическое образование. Углерод накапливается в магме при ассимиляции ею известняков и пород, содержащих углистое вещество. При этом безразличен состав самой магмы, поэтому графит встречается в магматических породах разного состава и иногда образует прекрасного качества скопления. Пример ‑ м-ние Ботогол (Бурятия), связанное со щелочной интрузией, где графит ассоциирует с нефелином, канкринитом, альбитом, микроклином, кальцитом.
2. Пегматиты. Пегматиты разного состава ‑ щелочные на том же Ботоголе и на Урале, сиенит-пегматиты (Урал), гранитные пегматиты Карелии и Украины.
3. Метаморфический генезис. Это может быть метаморфизм пород, содержащих органику ‑ графитовые гнейсы, мраморы; обжиг и метаморфизм углей ‑ Красноярский край, Шуньга на Белом море.
Изменение, применение. В поверхностных условиях графит легко истирается, несмотря на свою химическую стойкость.
Применение. Карандашное производство, графитовые стержни для атомных реакторов, смазочный материал при низких температурах.
Подгруппа алмаза
Химизм. Алмаз иногда содержит включения графита, минералов-спутников: оливина, граната, в составе его отмечаются N, B, O, которые возможно, являются изоморфными примесями.
Структура. Частицы в решетке располагаются по узлам гранецентрированного куба и в центрах четырех из восьми его октантов. КЧ=4. Связь ковалентная; куб. синг., Fd3m.
Морфология. Кристаллы имеют огранку {111}, {110}; часто округлые формы ‑ кубоиды, октаэдроиды; двойники по шпинелевому закону (по {111})‑ получаются уплощенные треугольной формы кристаллы. Грани часто тонко или грубо исштрихованы ‑ до ступенчатой, грубо пластинчатой скульптуры. Различают ювелирные алмазы и технические, среди которых выделяют борт ‑ светлые сростки, обломки, не годные к огранке, карбонадо ‑ пористые, коксовидные, с графитом, сростки и баллас ‑ округлые радиальнолучистые агрегаты.
Свойства. Цвет: бесцветный, зеленоватый, розоватый, желтоватый, розовато-лиловый до вишневого и черного. Природа окраски многообразна: это могут быть и дефекты структуры, и изоморфные примеси ‑ B, N (желтый), и механические примеси. Блеск алмазный, прозрачный до непрозрачного. Сп. cов. по {111} ‑ наличие гофрированных слоев // L3; Н=10. d=3,5. Специфична голубая люминесценция в фильтрованном ультрафиолете и синяя в катодных лучах.
Генезис. Экспериментально установлено, что алмаз ‑ высокобарическая (десятки - сотни килобар) модификация углерода, требующая и высоких температур (1200оС и выше). Где в природе реализуются такие условия? В земных условиях это либо большие глубины (100-200 км), соответствующие верхней мантии, либо метеоритные кратеры: при ударе метеоритов могут возникать давления такого порядка. Поэтому различают следующие генетические типы:
Тема 15. ПРОГНОЗИРОВАНИЕ И ОЦЕНКА ПОСЛЕДСТВИЙ ЧС - лекция, которая пользуется популярностью у тех, кто читал эту лекцию.
1. Кимберлитовые трубки ‑ взрывные образования, представляющие собой брекчии пород ультраосновного состава с обломками пород кровли и ксенолитами глубинных пород: эклогитов, гранатовых перидотитов, гроспидитов. Это классические кимберлиты района Кимберли (ЮАР) и в целом южной и юго-западной Африки; кимберлиты Якутии.
2. Иные алмазоносные глубинные породы ‑ эклогиты и перидотиты, не образующие трубок взрыва (ксенолиты в кимберлитах), ультраметаморфические эклогиты и мраморы Кокчетавского массива.
3. Импактные породы (Попигайский метеоритный кратер на севере Алданского щита, Аризонский кратер (США), кратер Рис (ФРГ).
На поверхности алмаз устойчив, и потому выделяют еще один важный в промышленном отношении тип месторождений ‑ россыпи, известные в Индии, Африке, Австралии, на С-З Урале.
Применение. Не надо думать, что алмаз ценен лишь в ювелирном качестве, хотя истории знаменитых алмазов посвящена огромная литература, очень важно его техническое применение ‑ в буровых коронках, в качестве абразива, в наконечниках прецизионных инструментов, в микрохирургии глаза. Добыча природных алмазов не покрывает потребности в них, и потому производство синтетических (технических, а теперь и ювелирных) алмазов составляет более 20 т ежегодно.
Не останавливаясь специально на характеристике последней подгруппы самородного углерода, лишь отметим, что лонсдейлиит представляет собой гексагональную модификацию со структурой вюртцита, очень редок и встречается в импактных породах.





















