- Уравнения состояния
12.3. Уравнение состояния
Опыт показывает, что между основными параметрами, характеризующими состояние газа (давлением, плотностью и температурой), существует определённая зависимость.
Уравнение  , устанавливающее связь между этими параметрами, называется уравнением состояния.
, устанавливающее связь между этими параметрами, называется уравнением состояния.
Поэтому состояние любого газа определяется двумя параметрами (например, плотностью и температурой), так как третий параметр (давление) можно найти из уравнения состояния.
Для идеального газа уравнение состояния можно записать в виде
 ,
,
где R - газовая постоянная, зависящая от относительной молекулярной массы газа m. Для воздуха m = 29,  .
.
Под идеальным газом принято понимать газ, в котором взаимодействие молекул между собой осуществляется посредством упругих столкновений, а линейный размер молекулы по сравнению со средним молекулярным расстоянием мал.
Существенное отличие свойств воздуха от свойств идеального газа наблюдается при высоких давлениях и низких температурах.
Рекомендуемые материалы
12.4. Удельные теплоёмкости газа
Рассмотрим некоторый произвольный термодинамический процесс. Количество теплоты dq, подведенное к 1 кг газа в этом процессе, выразим через приращение температуры газа dT:
 .
.
Множитель c, представляющий собой количество теплоты, необходимое для подогрева 1 кг газа на 1 град в данном процессе, называется удельной теплоёмкостью.
Удельная теплоёмкость существенно зависит от характера процесса.
Рассмотрим теплоёмкости, соответствующие процессам, происходящим при постоянном объёме cV и давлении cp. Зависимость между удельными теплоёмкостями идеального газа cV и cp определяется следующим соотношением
 .
.
В термодинамике и газодинамике важное значение имеет отношение теплоёмкостей  . Величина k зависит от структуры молекулы газа. Так, для идеальных одноатомных газов k = 1.66, для двухатомных газов, в том числе и для воздуха, k = 1.4.
. Величина k зависит от структуры молекулы газа. Так, для идеальных одноатомных газов k = 1.66, для двухатомных газов, в том числе и для воздуха, k = 1.4.
12.5. Первый закон термодинамики
Пусть некоторое количество газа находится в равновесии. Обозначим через dQ количество подведённой к газу извне теплоты. В общем случае подвод теплоты приводит к изменению внутренней энергии газа dU и объёма. При изменении объёма газ совершает внешнюю работу, равную dL=pdV. Поэтому
 ,
,
или, относя все величины к 1 кг массы газа, получаем
 ,
,
где dq - суммарная теплота, подведенная к 1 кг массы газа извне, du - изменение внутренней энергии 1 кг массы газа,  - работа, затрачиваемая на расширение ( 1 / r - объём, занимаемый 1 кг массы газа).
- работа, затрачиваемая на расширение ( 1 / r - объём, занимаемый 1 кг массы газа).
При постоянном объёме dV = 0, dQ=dU или dq=du, т.е. вся теплота, подводимая к газу, тратится на увеличение его внутренней энергии. Поэтому
 .
.
Пренебрегая зависимостью cV от температуры и имея в виду, что при T=0 u = 0, имеем
 .
.
Внутренняя энергия является одной из функций состояния газа.
Используя формулы
 .
.
Уравнение является математическим выражением первого закона термодинамики.
Энтальпия. Введём ещё одну функцию состояния i, определяемую соотношением
 .
.
Или, пренебрегая изменением cp,
 .
.
Эта функция называется энтальпией. Из определения энтальпии следует, что её приращение di представляет собой приращение теплоты dq в процессе p=const. Имея это в виду, из первого закона термодинамики  , интегрируя его в предположении p=const, получим
, интегрируя его в предположении p=const, получим
 .
.
Используя уравнение состояния и соотношение  , имеем
, имеем
 .
.
Энтропия. При изучении течения газа часто используют понятие энтропии. Эта функция определяется дифференциальным соотношением
 .
.
Найдём связь между энтропией и энтальпией
 ,
,
из первого закона термодинамики
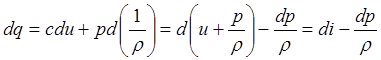
следует
 .
.
При скоростях движения жидкости сравнимых со скоростью звука или их превышающих, на первый план выдвигаются эффекты, связанные с сжимаемостью жидкости. Такое движение на практике наблюдается в газах. Поэтому о гидродинамике больших скоростей говорят обычно как о газодинамике.
Чаще всего в газодинамике приходится иметь дело с очень высокими значениями чисел Рейнольдса. За исключением отдельных случаев ( наиболее ярким из которых является отрыв сверхзвукового потока ) при высоких значениях числа Рейнольдса вязкость оказывается не существенной для движения газа практически во всем пространстве. Поэтому в газодинамике часто газ рассматривают как идеальную жидкость.
Движение газа имеет существенно различный характер в зависимости от того, является оно дозвуковым или сверхзвуковым.
С изучением сверхзвуковых течений связано решение ряда практических проблем, возникающих при создании самолетов, ракет, турбин, снарядов, аэродинамических труб для получения потоков со сверхзвуковыми скоростями.
12.6. Характеристики заторможенного потока. Газодинамические функции
Параметры газа, соответствующие нулевой скорости потока, называются параметрами торможения. Давление, плотность, температура и энтальпия, соответствующие этому состоянию называются давлением, плотностью, температурой и энтальпией торможения и обозначаются po, ro, To, io. Соотношение между местными параметрами потока и параметрами торможения определяются с помощью газодинамических функций t, p, e.
Аргументом газодинамических функций является число Маха
 или коэффициент скорости
или коэффициент скорости  . Где V - местная скорость потока, а - скорость звука в газе,
. Где V - местная скорость потока, а - скорость звука в газе,  - критическая скорость звука. Установим связь между числом Маха и коэффициентом скорости. Запишем уравнение энергии в виде
- критическая скорость звука. Установим связь между числом Маха и коэффициентом скорости. Запишем уравнение энергии в виде
 .
.
Разделим уравнение на  , получим
, получим
 .
.
Отсюда
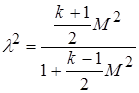
или разрешив относительно числа Маха, имеем
 .
.
Для вывода газодинамических функций запишем уравнение энергии
 .
.
Умножим уравнение на  и учтем, что
и учтем, что  . В результате имеем
. В результате имеем
 .
.
Уравнение состояния газа  , записанное для параметров торможения
, записанное для параметров торможения  , позволяет получить соотношение
, позволяет получить соотношение
 .
.
Из уравнения адиабаты  по аналогии для параметров торможения имеем
по аналогии для параметров торможения имеем
 .
.
Из последних трех равенств имеем
 ,
,  .
.
Воспользуемся теперь выражением для газодинамической функции t, запишем
 ,
,
 .
.
Газодинамические функции широко используются для расчета изэнтропических течений газа. Во многих учебниках по газовой динамике они представлены в виде таблиц. Из выражений для газодинамических функций при М = l = 1 критические параметры газа могут быть найдены через параметры торможения po, ro, To
Вместе с этой лекцией читают "1.1. Процессы микробной химии".
 ,
,  ,
,  .
.
При практических расчетах используют еще одну газодинамическую функцию, называемую удельным секундным расходом q :
 .
.
Воспользовавшись выражением для газодинамической функции e а также связью между критическими параметрами и параметрами торможению, учитывая  , имеем
, имеем
 .
.
Нетрудно заметить, что при l = 0 и  получим q=0. В первом случае расход равен нулю, так как газ неподвижен. Во втором случае p = r = T = 0.
получим q=0. В первом случае расход равен нулю, так как газ неподвижен. Во втором случае p = r = T = 0.




















