Производство уксусной кислоты из ацетальдегида (1022750), страница 3
Текст из файла (страница 3)
: 

Зависимость изменения энергии Гиббса ΔG от температуры
Пользуясь уравнением изотермы Вант-Гоффа:
ΔG = – RT•lnkp,
Из него выразим константу равновесия
lnkp = – ΔG /(RT)

Данные результаты показывают, что реакция окисления ацетальдегида в уксусную кислоту идёт с выделением теплоты. Причём с увеличением температуры реакционной массы абсолютное значение ΔН°Т немного увеличивается. Согласно принципу Ле-Шателье для увеличения выхода продукта реакции, идущей с выделением теплоты, необходимо осуществлять отвод тепла от реакционной смеси.
Изменение энтропии для данной реакции во взятом интервале температур отрицательно. То есть в изолированной системе самопроизвольное протекание данной реакции в прямом направлении невозможно. Значение ΔS Т с повышением температуры возрастает, следовательно возрастают и термодинамические трудности протекания процесса. Однако на практике имеют дело с неизолированными системами и этот параметр в нашем случае не может служить критерием направленности химической реакции.
О направленности химической реакции в изобарно-изотермических условиях судят по значению изменения свободной энергии Гиббса ΔG° Т. Расчёт показывает, что ΔG° Т во всём изученном интервале температур отрицательно, следовательно в пределах этих температур возможно самопроизвольное протекание реакции в прямом направлении. При увеличении температуры абсолютное значение изменения свободной энергии Гиббса увеличивается, значит с увеличением температуры не возникает трудностей для протекания процесса в прямом направлении.
Константы равновесия для всего интервала температур значительно больше единицы, поэтому в реакционной смеси при достижении состояния равновесия продукты реакции будут существенно преобладать над исходными веществами. С увеличением температуры соотношение между продуктами реакции и исходными веществами в равновесном состоянии будет уменьшаться (уменьшается значение kp), следовательно и выход продукта уменьшится. Для увеличения выхода необходимо постоянно охлаждать реакционную смесь, отводя выделяющуюся теплоту.
Для увеличения скорости процесса необходимо повышать концентрацию исходных веществ, понижать температуру и повышать давление.
Кинетика процесса.
Для увеличения скорости процесса необходимо повышать концентрацию исходных веществ, повышать температуру и повышать давление. То есть термодинамика требует понижение температуры, а кинетика – увеличение. Эта проблема решается путем ввода катализатора, при этом достигается высокая скорость и селективность процесса.
Катализаторы, применяемые в данном процессе, должны обеспечивать протекание всех стадий с одинаковой скоростью. Некоторые катализаторы, например соли железа, меди и кобальта, ускоряют окисление альдегида в надуксусную кислоту, но недостаточно повышают скорость второй стадии- образование уксусного ангидрида. Применение ацетата марганца или комбинированного кобальт-марганцевого катализатора устраняет этот недостаток, так как эти катализаторы способствуют восстановлению надуксусной кислоты.
Предполагают, что при окислении ацетальдегида в уксусную кислоту валентность металла в ацетате меняется, что обеспечивает перенос кислорода.

Таким образом, применение в качестве катализаторов солей кобальта, меди и железа, а также снижение температуры, ниже оптимальной, приводят к накоплению пероксиуксусной кислоты(CH3COOОH), что повышает взрывоопасность производства. Верхний предел допустимой температуры определяется высокой летучестью ацетальдегида и усилением развития побочных реакций, например, образование метилацетата (2) и этилидендиацетата (3):
2CH3CHO + 1,5O2 = СН3СООСН3 + CO2 + H2O, (2)
3СН3СНО + O2 = СН3СН(ОСОСН3)2 + H2O. (3)
Технологическая схема производства уксусной кислоты окислением ацетальдегида
На рис. 1.1 представлена технологическая схема производства уксусной кислоты из ацетальдегида на марганцевом катализаторе.
Рисунок 1.1 Технологическая схема производства уксусной кислоты окислением ацетальдегида
1-смеситель катализаторного раствора,2-смеситель раствора ацетальдегида,3-окислительная колонна(реактор),4-брызгоулавитель,5- рассольный конденсатор, 6-сепаратор жидкости и газа, 7-ректификационная колонна
Технологический процесс производства уксусной кислоты окислением ацетальдегида состоит из трех последовательных стадий:
Растворы катализатора и ацетальдегида в циркуляционной уксусной кислоте подаются из смесителей 1 и 2 в нижнюю часть окислительной колонны — реактора барботажного типа 3. Температурный режим в колонне поддерживается с помощью размещенных в ней охлаждающих змеевиков, по которым циркулирует вода. По всей высоте в колонну через несколько труб подается под давлением 4*105 Па кислород, который барботирует через жидкость, заполняющую колонну. Парогазовая смесь, содержащая продукты окисления, выводится из колонны 3 через брызгоуловитель 4 и поступает в конденсатор 5, охлаждаемый рассолом, и из него в сепаратор 6. Из сепаратора конденсат, состоящий из уксусной кислоты и ацетальдегида, возвращается в окислительную колонну, а несконденсировавшиеся газы промываются водой и выпускаются в атмосферу. Для предотвращения возможности взрыва пероксиуксусной кислоты парогазовая смесь, выходящая из колонны, разбавляется азотом, который подается в брызгоуловитель 4. Жидкая уксусная кислота, выходящая из брызгоуловителя колонны 3, делится на два потока. Меньший из них (циркуляционная кислота) направляется в смесители 1 и 2 для приготовления растворов катализатора и ацетальдегида, а больший поступает на ректификацию в колонну 7 для получения товарного продукта. Из нижней части колонны 7 выводится в виде кубового остатка раствор катализатора, поступающий на регенерацию.
Основной аппарат технологической схемы — окислительная колонна. Она представляет цилиндр с расширенной верхней частью, играющей роль брызгоуловителя, высотой 12 и диаметром 1 м. Колонна изготовлена из алюминия или хромоникелевой стали, мало подверженных коррозии в уксуснокислой среде. Внутри колонна имеет полки, между которыми размещены змеевиковые холодильники для отвода реакционного тепла и несколько труб для подачи кислорода.
В целом технология характеризуется удовлетворительным выходом уксусной кислоты (92% на ацетальдегид) и достаточно высокой конверсией за один проход (95% по ацетальдегиду). К недостаткам технологии следует отнести:
-
сложную конструкцию реактора окисления из стойких к коррозии материалов;
-
низкую степень использования тепла реакции из-за невысокого его потенциала. Охлаждающий реактор конденсат с температурой около 60°С пригоден только для питания котлов утилизаторов других производств;
-
использование на стадии очистки химических реагентов;
-
однократное без регенерации и утилизации использование катализатора.
Операторная схема процесса:
Структурная блок-схема.
N300
N404
N122
N011

N23
N34
N401

2
3
4

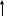




N012
N023
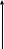


N403
N402
В структурной схеме элементы химико-технологической системы представляются в виде блоков, имеющих входы и выходы. Блоки соответствуют декомпозиционному элементу в зависимости от цели декомпозиции и от исходной информации.
1- смешение 2- окисление; 3- конденсация и разделение газовых и жидких потоков; 4- ректификация с рециклом по ацетальдегиду.
N011-катализатор
N012 –свежий технический ацетальдегид
N12 –ацетальдегид пошедший на окисление
N023 –поступающий кислород
N300 –выхлопные газы
N402 –ацетальдегид после ректификации
N401 –получаемая уксусная кислота
N403 -метилацетат
N404-этилидендиацетат
Исходные данные для расчета.
| Показатель | Значение | |
| Состав технического кислорода, % (по объему) | ||
| -кислород (γкисл) | 97 | |
| -азот (γазот) | 3 | |
| Состав технического ацетальдегида , % (по массе) | ||
| -ацетальдегид (γацеталь) | 99,5 | |
| -уксусная кислота (γукс.) | 0,2 | |
| -вода (γвода) | 0,3 | |
| Конверсия ацетальдегида, % Хацеталь | 90 | |
| Селективность образования уксусной кислоты, % φуксацет | 96,5 | |
| Селективность превращения ацетальдегида, доли | ||
| -в метилацетат φметилацеацет | 0,02 | |
| -в этилидендиацетат φэтилендиацет | 0,015 | |
| Распределение непрореагировавшего ацетальдегида, % | ||
| -с выхлопными газами (γацетальвыхлоп) | 32 | |
| -с жидкими продуктами на ректификацию (γацетальжидк) | 68 | |
| конверсия кислорода, % Хкисл | 94 | |
| Базис расчета, кг ледяной уксусной кислоты(99,8 %-ный водный раствор по массе) | 1700 | |
Пукс. к-ты(100%)=1700*0.998=1696,6 кг
Уравнения:
СН3СНО + 0,5O2 = CH3СOOH
2CH3CHO + 1,5O2 = СН3СООСН3 + CO2 + H2O
3СН3СНО + O2 = СН3СН(ОСОСН3)2 + H2O
Составление уравнений материального баланса.
1)Уравнение по поступающему на окисление ацетальдегиду:
(G012*γацеталь)/Мацетал+N12*(1- Хацеталь)* γацетальжидк=N12
2)Образующийся метилацетат.
Хацеталь*N12*0,5* φметилацеацет=N403
3)Образующийся этилендиацетат.
Хацеталь*N12*0,333* φэтилендиацет=N404
4)Базисное уравнение по уксусной кислоте.
Пукс. к-ты(100%)/Mукс=N12* Хацеталь* φуксацет+(G012*γукс.)/Мацетал
5)Баланс по прореагировавшему кислороду.
(G023*Хкисл.* γкисл)/Мкисл=N403*1,5+N404+ (Пукс. к-ты(100%)/Mукс)*0,5
6)Общее кол-во воды по реакции.
(G012*γвода)/Мвода+N403+N404=nвод.
7)Баланс по выхлопным газам.
N300=(G023*(1-Хкисл.)* γкисл)/Мкисл+(G023*γазот)/Мазот+
+N12* γацетальвыхлоп+ N403
N403=NCO2

















