Водородный показатель 0,1М раствора LiOН:
равен 11
больше 11
меньше 11
Водородный показатель 0,1М раствора LiOН:
равен 11
больше 11
меньше 11
Донорно-акцепторный механизм образования связи в соединении [Cr(H2O)4 F2]CI осуществляется между:
Сг3+ и Cl-
Сг3+ и F-
[Cr(Н2O)4F2]+ и Сl-
Сr3+ и H2O
В тетраэдрическом поле лигандов более высокую энергию имеют орбитали
Зdy
4s
3dE
4р
Если центральный атом в молекуле находится в sp² -гибридном состоянии, то пространственное строение молекулы может быть
октаэдрическое
линейное
тетраэдрическое
в виде плоского треугольника
Если центральный атом в молекуле находится в sp-гибридном состоянии, то пространственное строение молекулы может быть
в виде плоского треугольника
линейное
октаэдрическое
тетраэдрическое
угловое
Укажите пространственное расположение электронных облаков при sp³-гибридизации:
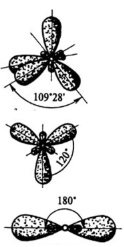
Ионная сила 0,5М водного раствора Sr(OH)2 равна:
1,50
1,00
1,25
3,50
0,50
Кислую среду в водном растворе имеет:
сульфат натрия
карбонат кальция
сульфат алюминия
аммиак
С увеличением концентрации слабой кислоты
рН раствора увеличивается
степень диссоциации увеличивается
степень диссоциации уменьшается
степень диссоциации не меняется
Константы гидролиза сульфит-иона SO32- по 1-й и 2-й ступени равны....
(KД1=1,7-10-2; Kд2 = 6,3-10-8)
Kr1 = 4,59-10-7, Kr₂ = 1,5-10-13
Kr1=1,59-10-7, Kr₂ = 5,9-10-13
Kr1 = 3,60-10-8, Kr₂ = 5,9-10-10
Kr1 =1,59-10-10, Kr₂ = 2,0-10-11
Для увеличения ЭДС серебряно-цинкового гальванического элемента на 0,059 В активность потенциалопределяющего иона анода в растворе электролита нужно ...
увеличить в 10 раз
уменьшить в 1000 раз
уменьшить в 100 раз
увеличить в 100 раз
Установлено, что при нахождении сплава Fe - Ni в коррозионной среде за некоторое время поглотилось 28 мл кислорода и выделилось 56 мл водорода (условия считать нормальными), масса прокорродировавшего при этом металла составила...
(E0Fe2+/Fe=-0,440В, E0Ni2+/Ni=-0,250 В)
139,5 мг, Fe
146,8 мг, Ni
293,5 мг, Ni
279,0 мг, Fe
За некоторое время в коррозионном растворе прокорродировало 281 мг металла из сплава Cu - Cd, объем выделившегося водорода (условия считать нормальными) при этом составил ... (E0cu2+/cu = + 0,337 B, E0ca2+/ca = - 0,403 В)
11,2 мл
56 мл
28 мл
112,0 мл
Установлено, что при атмосферной коррозии сплава Al - Fe Mn поглотилось 28 мл кислорода и выделилось 28 мл водорода (условия считать нормальными), при этом масса прокорродировавшего металла составила ...
(E0 Al3+ /Al = -1,662 В, E0 Мп2+/Мп=-1.180 В,
E0 Fe2+/Fe = -0,440 B)
135,0 мг, А
127,0 мг, Мп
67,5 мг, А
90,0 мг, Ге
При электролизе водного раствора сульфата натрия на никелевых электродах при нормальных условиях выделилось 6 мл водорода и 2 мл кислорода, выход по току которого (%) составил:
33
100
67
Уравнение химической реакции, в которой изменение стандартной энтальпии соответствует стандартной энтальпии образования твердого карбоната кальция при 298К
Сак + 1,502 + Сграфит = СаСО3,r
Сак + 0,502 + СО2 = СаСО3,r
СаOк + СО2,r СаСО3,r
Для реакции Ѕі,к+2H2=SiН4 при 1000 К начальные концентрации водорода и тетрагидрида кремния были равны (моль/л): CH2= 0,1, а СSіH4 = 0,005. В равновесной смеси при заданных условиях концентрация водорода была равна 0,01 моль/л. Константа равновесия Кс будет равна:
400
500
300
600
700
Как будет изменяться Кд угольной кислоты Н2СО3 = H+ + НСО3 с увеличением температуры?
Не изменится, т.к. ∆rН0 > 0
Увеличиваться, т.к. ∆rН0 > 0
Уменьшаться, т.к. ∆rН0> 0
Реакция протекает по уравнению 2A = В. Начальная концентрация вещества А равна 0,2 моль/л. Константа равновесия Кс = 0,5. Равновесная концентрация вещества А СА (моль/л) равна:
0,017
0,17
0,015
0,03.
0,02
Критериями самопроизвольного протекания процесса и установление равновесного состояния системы считается соответственно
Δ G=0, Δ G>0
Δ G> 0, Δ G<0
Δ G<0, Δ G=0




