Примеры использования диаграммы i,s
Примеры использования диаграммы i,s.
1. Определение параметров состояния водяного пара.
Водяной пар – не идеальный газ. Формулами для идеального газа пользоваться нельзя. Водяной пар это реальный газ. Для определения параметров пользуемся уравнением первого закона термодинамики. Расчеты либо по таблицам, либо по диаграмме i,s.
Допустим что:
Р1 пара =5 МПа
t1=4000C
Определить остальные параметры состояния этого пара.
Решение:
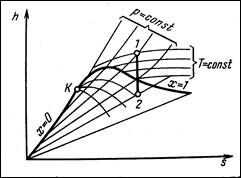
По диаграмме i,sдля водяного пара находим точку пересечения температуры и давления: Р1 =5 МПа, t1=4000C
Рекомендуемые материалы
Далее: сделать рисунок с этой точкой – другие изотермы и изобары не надо.
2. Находим остальные параметры:
Удельный объем: v1=0,06 м3/кг
i1=3200 кДж/кг
s1=6,67 кДж/(кг ×град)
u1=i1-p1v1=3200-5000×0,06=-2900 кДж/кг.
Второй тип задач: расчет процессов в диаграмме i,s.
Напишем задачу:
Пар из состояния точки 1, предшествующей задачи, адиабатно расширяется до состояния со степенью сухости х=0,9. Определить параметры пара в конечной точке процесса, а тек же Di, Ds, Du, a, q.
1. По диаграмме i,s находим параметры точки 2.
р2=125 кН/м2=
t2=1100C
v2=1,1 м3/кг
i2=2455 кДж/кг
s2=6,67 кДж/(кг град)
u2=i2-p2v2=2455-125×1,1=2317,5кДж/кг
2. Расчет изменения параметров состояния:
Di=i1-i2=2455-3200=-745
Ds=s1-s2=0 – адиабатный процесс.
Du=u2-u1=2317,5-(-2900)=5317,5 кДж/кг
q=0
a=-uD=-5317,5 кДж/кг
В других процессах:
Применяя I закон термодинамики:
Изохорный процесс: а=0 Þ q=Du.
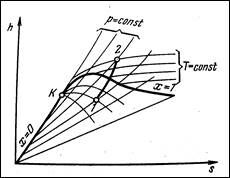
Изобарный процесс: q=Di Þ a=q-Du.
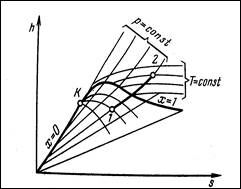
Изотермический процесс: -Du=0 q=a q=tDs.
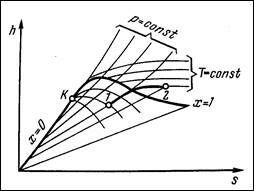
Влажный воздух.
Большинство газов, применяемых в технике, содержат пары тех или иных жидкостей. Наиболее распространенными являются смесь воздуха или какого-нибудь другого пара с водяным паром, смесь воздуха с парами бензина, керосина и т.д.
Характер изменения параметров парогазовой смеси имеет большое значение в расчетах процесса сушки, кондиционирования воздуха, сверхзвуковых аэродинамических труб и т.д.
Содержание водяного пара в атмосферном воздухе зависит от метеорологических условий, а также от наличия источников испарения воды и колеблется в широких пределах: от 4% (по массе).
Смесь, состоящая из сухого воздуха и насыщенного водяного пара, называется насыщенным влажным паром. Смесь сухого воздуха и перегретого водяного пара – ненасыщенным влажным воздухом.
Температура, до которой необходимо охлаждать ненасыщенный влажный воздух, чтобы содержащийся в нем пар стал насыщенным, называется температурой точки росы. При дальнейшем охлаждении влажного воздуха (ниже точки росы) происходит конденсация водяного пара. Поэтому температуру точку росы часто используют как меру содержания в воздухе воды в парообразном состоянии.
Обычно к влажному воздуху применяют уравнение для идеальных газовых смесей. Так как в процессах сушки количество водяного пара в воздухе может меняться, а количество сухого воздуха остается постоянным, то целесообразно относить все величины к 1 кг сухого воздуха.
Масса пара в 1 м3 влажного воздуха, численно равная плотности пара rП, при парциальном давлении рП, называется абсолютной влажностью.
Отношение действительной абсолютной влажности воздуха rП к максимально возможной абсолютной влажности rs при той же температуре называют относительной влажностью и обозначаются через j:
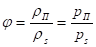
где рП – парциальное давление водяного пара во влажном воздухе;
рs – максимально возможное парциальное давление водяного пара при данной температуре.
В лекции "Проблема развития человеческих ресурсов" также много полезной информации.
Величина j выражается в процентах или относительных единицах.
Поскольку 0 £ рП £ рs ,, то 0 £ j £ 100% (ли соответственно 0 £ j £ 1). Для сухого воздуха j =0, для насыщенного j =100%.
Отношение массы водяного пара МП, содержащегося во влажном воздухе, к массе сухого воздуха МВ называют влагосодержанием воздуха и измеряют в килограммах на килограмм:
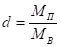
Относительную влажность воздуха определяют с помощью прибора, называемого психрометр. Психрометр состоит из двух одинаковых термометров, один из которых имеет резервуар, обернутый батистом, непрерывно смачиваемый водой. С поверхности резервуара термометра происходит испарение воды, интенсивность которого зависит от влажности окружающего воздуха: чем меньше насыщен влагой окружающий воздух, тем интенсивнее испарение с “мокрого” термометра и тем ниже его показания, так как на испарение расходуется тепло. По разности показаний “сухого” и “мокрого” термометров с помощью психометрической таблицы можно определить относительную влажность воздуха.
Энтальпия I влажного воздуха является одним из основных его параметров и широко используется при расчетах сушильных установок, систем вентиляции и кондиционирования воздуха. Энтальпию влажного воздуха обычно относят к единице массы сухого воздуха, т.е. к 1 кг, и определяют как сумму сухого воздуха и водяного пара, кДж/кг сухого воздуха.






















