Термодинамические процессы
Термодинамические процессы.
Изменение состояния термодинамической системы во времени называется термодинамическим процессом.
Термодинамический процесс называется равновесным, если все параметры системы при его протекании меняются достаточно медленно.
В термодинамике изучаются процессы, подчиненные определенной закономерности. За условие протекания таких процессов принимают постоянство распределения подводимой теплоты между внутренней энергией газа и работой, которую он совершает. Т.е. внутренняя энергия является функцией только температуры, а теплоемкость не зависит от температуры и является постоянной. Такие процессы называют политропными.
Теплота всегда может быть выражена произведением теплоемкость на изменение температуры. Поэтому можно записать:
dq = cПdT,
где сП – теплоемкость политропного процесса, т.е. количество теплоты, которое в данном процессе необходимо подвести к 1 кг газа, чтобы повысить его температуру на 1 градус.
Любой произвольный процесс можно описать уравнением:
pvn=const,
Рекомендуемые материалы
подбирая соответствующие значения n.
Показатель политропы n может принимать любое численное значение от - ¥ до + ¥, но для данного процесса он является величиной постоянной.
Зависимость между начальными и конечными параметрами процесса:

Работа расширения газа:

Количество подведенной или отведенной в процессе теплоты:

Теплоемкость идеального газа в политропном процессе cn. При постоянных сv, k, n теплоемкость сn=const, поэтому политропный процесс определяют как процесс с постоянной теплоемкостью.
Изменение энтропии:

Политропный процесс имеет обобщающее значение, т.к. охватывает все процессы.
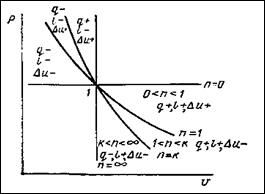
Рассмотрим чему равен показатель политропы в каждом из процессов:
PVn=const
| Процесс | n | cП |
| Изобарный | 0 | cp |
| Изотермический | 1 | ¥ |
| Адиабатный | k | 0 |
| Изохорный | ±¥ | cv |
Изохорный PV= const; V=const;  ; n=±¥.
; n=±¥.
ИЗОХОРНЫЙ ПРОЦЕСС – процесс сообщения или отнятия тепла при постоянном объеме газа v=const.

Уравнение изохоры: p/T=R/v=const.
Зависимость между начальными и конечными параметрами процесса:

т.е. давление газа прямо пропорционально его абсолютной температуре.
Так как dv = const, то газ в этом процессе работы не производит и уравнение первого закона термодинамики приводится к виду: dq = du или q = cv(T2 – T1).
На p-v диаграмме изохора представляется прямой, параллельной оси давлений. Направление процесса из начальной точки 1 вверх характеризует увеличение внутренней энергии и нагрев газа, а вниз – охлаждение путем отвода теплоты в окружающую среду.
Работа расширения в этом процессе равна нулю, т.к. dv=0 – газ работы не совершает.
Количество теплоты, подведенной к рабочему телу в процессе 12 при сv=сonst, определяется:
q=cv(T2-T1)
Так как l=0, то в соответствии с первым законом термодинамики Du=q и:
Du=cv(T2-T1) при cv=const;
Изменение энтропии в изохорном процессе:
s2-s1=cvln(T2/T1),
ИЗОБАРНЫЙ ПРОЦЕСС - процесс сообщения или отнятия тепла при постоянном давлении газа р=const.

Зависимость между начальными и конечными параметрами процесса:

Из уравнения состояния идеального газа следует, что v/T=R/p=const,т.е. объем газа пропорционально его абсолютной температуре (закон Гей-Люсссака):
Работа расширения в этом процессе равна:
 ,
,
или так как pv1=RT1 и pv2=RT2, то l=R(T2-T1)
Количество теплоты, сообщаемое газу при нагревании или отдаваемое им при охлаждении, при ср=сonst, определяется:
q=cр=(T2-T1)
Du=cv(T2-T1) = i2 – i1 при cv=const;
Таким образом, количество подводимой теплоты равно изменению энтальпии газа.
В p –v- диаграмме процесс представлен прямой линией, параллельной оси абсцисс. Процесс расширения идет направо, сжатие - налево. В первом случае при увеличении объема газ производит работу расширения, определяемую площадью прямоугольника под линией процесса, и в тоже время нагревается, следовательно, извне теплота подводится для нагрева газа и для совершения работы сжатия. Во втором случае газ сжимается, следовательно, на него извне затрачивается работа сжатия, но эта работа превращается в теплоту, а так как газ не только нагревается, но и охлаждается, то от него надо отводить в окружающую среду всю теплоту, как взятую от внутренней энергии, так и эквивалентную сжатию.
Изменение энтропии в изохорном процессе :
s2-s1=cvln(T2/T1),
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС - процесс сообщения или отнятия тепла при постоянной температуре t=const.
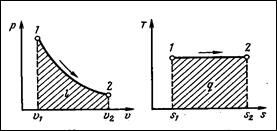
Зависимость между начальными и конечными параметрами процесса:

Уравнение изотермы pv=RT=const, т.е. давление и объем обратно пропорциональны друг другу, так что при изотермической сжатии давление газа возрастает, а при расширении – падает (закон Бойля-Мариотта).
Так как температура в процессе не меняется, то внутренняя энергия газа также остается постоянной. Поэтому вся подведенная теплота превращается в работу расширения газа и обратно, вся работа, затраченная на сжатие газа должна быть отведена в окружающую среду в форме теплоты.
Работа расширения в этом процессе равна:
a=RTln(v2/v1)=RTln(p1/p2)
q=a
Изменение энтропии в изотермическом процессе :
s2-s1=q/T=Rln(v2/v1)=Rln(p1/p2)
Теплоемкость равна ¥. Физический смысл этой бесконечности заключается в том, что ни при каких конечных значениях теплоемкости температура газа не может быть изменена, так как вся подводимая теплота полностью превращается в работу.
На р-v диаграмме кривая процесса представлена равнобокой гиперболой. Если процесс идет направо, то происходит расширение газа. Газ совершает работу, соответствующую площади под кривой процесса, и к нему необходимо подводить теплоту, эквивалентную этой работе. Если процесс идет налево – происходит сжатие газа, на которое затрачивается теплота, эквивалентная этой работе. Так как произведение pv увеличивается при увеличении температуры, то изотерма тем дальше отстоит от начала координат, чем более высокую температуру она принимает.
АДИАБАТНЫЙ ПРОЦЕСС – процесс без сообщения или отнятия тепла извне (dq=0, n=k).
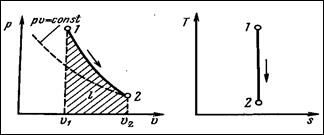
Для того, чтобы осуществить такой процесс, следует либо теплоизолировать газ, либо поместить его в адиабатную оболочку, либо провести процесс настолько, быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванной сжатием или расширением газа.
Уравнение адиабаты при постоянной теплоемкости сv=const для идеального газа:
pvk= const
где k=cp/cv – показатель адиабаты.
Зависимость между начальными и конечными параметрами процесса:

между T и v:

между р и Т:
Вместе с этой лекцией читают "Система маркетинговой информации".

Работа расширения при адиабатном процессе согласно первому закону термодинамики совершается за счет уменьшения внутренней энергии и равна:

В данном процессе теплообмен газа с окружающей средой исключен, поэтому q=0. Выражение с=dq/dT показывает, что теплоемкость адиабатного процесса равна нулю.
Поскольку dq=0, энтропия рабочего тела не изменяется ds=0 и s=const.
Адиабата представляет собой гиперболу более крутую, чем изотерма.

















