Основы теории горения
Модуль №3
Лекция № 8. Основы теории горения.
Энергетика химических связей и теплота сгорания топлива.
Энергетическая сущность химического процесса горения заключается в разрыве старых химических связей в молекулах горючего и кислорода и в образовании новых химических связей в молекулах продуктов сгорания. Образование новых связей сопровождается выделением тепла (экзотермический процесс), а разрыв существующих связей может происходить при наличии притока тепла извне (эндотермический процесс).
Разность между выделением и поглощением тепла равна изменению внутренней энергии системы Du. Согласно первому началу термодинамики, часть этой внутренней энергии расходуется на приращение энтальпии веществ (тепловой эффект реакций Qэф), а другая часть совершает работу расширения над газообразными продуктами.
Du = Qэф + p×Dv,
где Dv - изменение числа молей в процессе реакции, которое может быть равным нулю, положительным или отрицательным;
p - статическое давление, при котором протекает процесс.
Тепловой эффект при постоянном давлении отличается от теплового эффекта при постоянном объеме на величину работы расширения. Одако эта разница столь не существенна по сравнению с величиной самого теплового эффекта, что при практических расчетах ею вполне можно пренебречь.
Рекомендуемые материалы
Тепловой эффект реакции горения, отнесенный к единице топлива, называют теплотой сгорания, которая взаимосвязана с энергией связи атомов в молекулах продуктов сгорания и исходных реагентов. Если известна энергия связей горючего, кислорода и продуктов сгорания, то можно определить теплоту сгорания. Рассмотрим реакцию горения водорода
Н2+0,5×О2=Н2Огаз+Qэф ,
где Qэф = 239 Мдж/кмоль - тепловой эффект реакции при р = const.
Молекула кислорода содержит два атома, соединенных друг с другом двойной молекулярной связью. Разрыв первоначальных связей между атомами в молекуле кислорода является эндотермическим процессом. Энергия связи атомов кислорода друг с другом равна Ео2 = 495 Мдж/кмоль. Разрыв связей между атомами водорода идет с поглощением тепла в количестве Ен2 = 436,2 Мдж/кмоль.
Найдем энергию связи атома кислорода с атомами водорода в молекуле Н2Огаз . Для этого предварительно вычислим работу расширения:
p×Dv=101,3×(1-1,5)×22,4= -1135 кдж/кмоль.
Изменение внутренней энергии в ходе реакции равно
Du = Ен2о - (Ен2+0,5×Ео2) = Qэф + p×Dv,
откуда
Ен2о = 436200+0,5×495000+239000-1135 = 921,6 Мдж/кмоль.
Если газообразные продукты сгорания водорода перейдут в жидкое состояние, то они выделят еще некоторое количество тепла. Эта теплота конденсации паров воды не является прямым следствием реакции горения. Поэтому теплота конденсации паров воды не может быть причислена к теплоте сгорания газообразного топлива. Следовательно, нормальной теплотой сгорания следует считать низшую.
Иногда для оценки силы химических связей в углеводородах производят сравнение теплоты сгорания данного углеводорода с теплотой сгорания механической смеси “свободного” молекулярного водорода со “свободным” твердым углеродом, взятым в пропорции углеводорода.
Таблица-Qн углеводородов и смеси C и H2в эквивалентных количествах
| Углеводороды | Qн , Мдж/кмоль | Qсм , Мдж/кмоль | Qн - Qсм |
| Метан СН4 | 803,6 | 875,2 | - 71,6 |
| Этан С2Н6 | 1428 | 1514 | - 86 |
| Пропан С3Н8 | 2040 | 2150 | - 110 |
| Бутан С4Н10 | 2658 | 2786 | - 128 |
| Пентан С5Н12 | 3265 | 3422 | - 157 |
| Этилен С2Н4 | 1315 | 1272 | 43 |
| Бутен С4Н8 | 2547 | 2542 | 5 |
| Ацетилен С2Н2 | 1257 | 1028 | 229 |
Данные этой таблицы позволяют сделать два важных вывода:
1. Теплота сгорания алканов, имеющих одинарную связь между атомами углерода в молекуле, меньше теплоты сгорания эквивалентной механической смеси водорода с углеродом. Это означает, что разрыв химических связей в углеводороде требует больше тепла, чем в молекулярном водороде и твердом углероде. Поэтому весьма выгодно производить предварительный крекинг алканов, например в регенераторах.
2. Теплота сгорания алкенов и алкинов, имеющих соответственно двойную и тройную связи между атомами углерода в молекуле, больше теплоты сгорания эквивалентной механической смеси водорода с углеродом.
Скорость реакции.
Скорость реакции показывает, насколько изменяется количество какого-либо вещества в единицу времени вследствие происходящего химического процесса.
Учение о кинетике химических процессов обогатилось теорией цепных реакций, в которой изучается конкретный механизм возникновения и развития микропроцессов в химических реакциях. Скорость реакции связана с концентрацией, которая подразделяется на абсолютную и относительную. В свою очередь абсолютная концентрация может быть общей и частной.
В технической литературе для упрощения записи концентрацию вещества А обозначают [A]. Абсолютная концентрация, в отличии от относительной концентрации вещества, зависит от температуры и давления согласно закону Менделеева - Клапейрона.
Скорость реакции может быть абсолютной общей и абсолютной удельной, отнесенной для гомогенной реакции к единице объема, а для гетерогенной - к единице поверхности на границе раздела фаз.
Изменение концентрации Dс за промежуток времени Dt дает среднюю удельную скорость гомогенной реакции, кмоль/(м3× сек)
wср = Dс/Dt.
Сужая интервал времени Dt до dt, получим истинную или мгновенную скорость реакции, кмоль/(м3× сек)
w = dс/dt.
В кинетике химических рекций существует понятие о порядке химической реакции. Если в процессе реакции необходимо столкновение двух молекул, то такая реакция называется бимолекулярной. Если для реакции необходимо столкновение трех нужных молекул, то это будет реакция третьего порядка, или тримолекулярная, и т. д. В общем случае
аА+bB =cC+dD.
Тогда порядок реакции определяется числом n=a+b, если a+b³ с+d.
Реакция первого порядка представляет собой необратимый распад молекулы на ее составляющие. Реакции третьего порядка и выше редко встречаются в природе.
Не каждый удар между молекулами реагентов заканчивается химическим актом между ними. В реакцию вступают лишь молекулы, обладающие большой индивидуальной энергией, достаточной для разрыва старых энергетических связей у реагентов.
Минимальная энергия, которой должны обладать молекулы в данной конкретной реакции, носит название энергии активации, Е кдж/кмоль. При энергии активации Е = 80 Мдж/кмоль процент активных молекул составляет 0,005-1,3% от общего числа. Наличие свободных атомов и радикалов молекул облегчает начальную стадию и дальнейший ход реакции между молекулами. Энергия активации при этом снижается в 5-10 раз. Активные центры могут появиться как результат распада некоторых молекул вследствие повышения температуры реагентов.
Чем больше температура реагентов, тем больше активных молекул, наделенных нужным уровнем энергии активации.
Продолжение лекции № 8
Закон действующих масс.
Сущность закона действующих масс состоит в том, что относительная скорость бимолекулярной реакции пропорциональна произведению концентрации реагирующих веществ:
wотн = k×A×B ,
где k - константа скорости реакции, которая зависит от энергии активации реагентов, от температуры реагентов и давления газовой среды.
Образование активных центров прекратится по мере израсходования запасов реагирующих веществ.
Обратимость реакций и константа равновесия реакций.
В процессе химической реакции количество начальных веществ уменьшается, а количество продуктов реакции увеличивается, что создает видимость одностороннего направления реакции. В большинстве газовых реакций наряду с прямой реакцией образования новых веществ идет обратная реакция разложение ее продуктов (диссоциация) и образование из них исходных начальных веществ. Чем больше образуется продуктов реакции, тем интенсивнее развивается обратная реакция. Закон действующих масс с полным правом можно применять как к прямой, так и к обратной реакции. Реакции, идущие в обоих направлениях, носят название химически обратимых и записываются таким образом:
аА+bB « cC+dD.
Скорость реакции слева направо обозначим w1, а справа налево w2:
w1 = k1×Aa×B b; w2 = k2×C c×D d.
Результирующая скорость реакции w будет равна разности скоростей, и в пределе стремиться к нулю (w = w1 - w2 ® 0). Наступает подвижное химическое равновесие, когда количество исходных веществ, вступающих в реакцию в единицу времени равно количеству этих веществ, получаемых в результате обратной реакции, т. е. w1 = w2, или
k1×Aa×B b = k2×С с×D d.
Отсюда получается
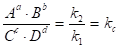
где kc - константа химического равновесия. Индекс “с” означает, что константа получена по безразмерным концентрациям веществ.
Абай Кунанбайулы - лекция, которая пользуется популярностью у тех, кто читал эту лекцию.
Следует отметить, что константа химического равновесия по относительным концентрациям (kc) равна константе по относительным парциальным давлениям (kр).
Константа равновесия может быть также выражена через абсолютные концентрации веществ и абсолютные парциальные давления. На константы химического равновесия оказывают влияние температура, при которой установилось равновесие, и общее давление газов. Величину константы равновесия определяют экспериментальным путем, изменяя температуру или давление в системе.
Принцип Ле-Шателье
Изменение направления хода равновесной химической реакции в зависимости от изменения того или иного активного фактора сформулировал Ле-Шателье.
Сущность принципа Ле-Шателье представляет собой частный случай проявления инерционных свойств материального мира и заключается в том, что всякое воздействие внешних сил на систему реагентов меняет ход реакции в том направлении, который будет препятствовать этому воздействию. Например, при подводе тепла извне в системе начнут развиваться эндотермические реакции, которые, поглощая внешний приток тепла, будут тормозить подъем температуры реагентов. При охлаждении системы, наоборот, начнут развиваться реакции, способствующие выделению тепла (экзотерми-ческие реакции), что будет компенсировать потерю тепла системой и тормозить понижение температуры реагентов.
Подобное происходит, когда изменяется внешнее давление, например, если начать повышать давление, то система окажет сопротивление изменению давления путем медленного образования таких химических реакций, которые сопровождаются уменьшением объема, общего числа молей, что будет тормозить повышение давления в системе. Остановка температуры или давления на новом уровне приведет к другому значению константы равновесия, т. е. к другому соотношению реагентов. Прибавление в систему какого-либо реагирующего вещества извне вызывает сдвиг реакции в сторону, ведущую к увеличению образования таких веществ, которые стремятся израсходовать добавленное вещество и тем затормозить повышение его концентрации.





















