Химическая кинетика и равновесие
Химическая кинетика и равновесие
Химическая кинетика - учение о скоростях химических реакций и механизме их протекания.
Под скоростью химической реакции
SаiAi = SbjBj,
что равносильно записи
a1A1 + a2A2 + ... + aiAi = b1B1 + b2B2 +....+ bjBj
понимают изменение концентрации любого из реагирующих веществ в единицу времени, т.е.
 ( моль/л×сек).
( моль/л×сек).
В этом уравнении перед изменением концентрации исходных веществ D[Ai] стоит знак минус, а продуктов реакции D[Bj]-знак плюс, поскольку в ходе реакции концентрации исходных веществ снижаются, а продуктов реакции возрастают. При таком определении скорость реакции всегда является положительной величиной.
Рекомендуемые материалы
В уравнении для скорости фигурируют стехиометрические коэффициенты, поскольку при протекании любой химической реакции массы реагирующих веществ всегда находятся в пропорциональных количествах, соответствующих их стехиометрическим коэффициентам. Действительно, согласно уравнению химической реакции,
из аi молей вещества Аi образуется bj молей вещества Bj,
а из -D[Ai] молей вещества Ai должно образоваться D[Bj] вещества Bj,
т.е. должна соблюдаться пропорция
ai ¾¾ bj
-D[Ai] ¾¾ D[Bj]
Следовательно, при протекании рассматриваемой реакции должно выполняться равенство
aiD[Bj]= -bjD[Ai]
Отсюда получается уравнение
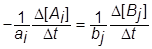
Разные реакции протекают с различными скоростями. Некоторые реакции протекают практически мгновенно. Так, например, протекают реакции в растворах между ионами противоположных знаков
Ag+ + Cl- = AgCl¯
или реакция нейтрализации кислот основаниями
H+ + OH- = H2O
Если в ходе быстрой реакции происходит выделение большого количества тепла, то такая реакция может протекать с взрывом. Так, смесь водорода с кислородом можно хранить при комнатной температуре длительное время без заметной реакции. При 500-6000 С начинается медленная реакция, которая становится очень быстрой (взрыв) при более высоких температурах. Другие реакции продолжаются минутами, часами, днями, а третьи, например некоторые геохимические процессы, совершающиеся в земной коре, растягиваются на десятки, сотни и тысячи лет. В холодных областях Вселенной возможны и более медленные процессы.
Рассматриваемая реакция является необратимой, если она протекает только в прямом направлении
SаiAi ® SbjBj,
или только в обратном направлении
SbjBj ® SаiAi.
Рассматриваемая реакция является обратимой, если она одновременно протекает как в прямом, так и в обратном направлениях
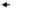
 SаiAi
SаiAi  SbjBj
SbjBj
Различают гомогенные и гетерогенные химические реакции. Если все вещества, участвующие в химической реакции, находятся в одной фазе, то реакция называется гомогенной. Во всяком гетерогенном процессе взаимодействие происходит на поверхности раздела фаз или в непосредственной близости от нее.
Скорость химической реакции зависит от целого ряда факторов. При заданных внешних условиях (температуре, давлении, среде, в которой происходит процесс) скорость является функцией концентраций реагирующих веществ.
Согласно закону действия (действующих) масс (1867 г), скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых (как правило, целых) степенях
v=kП[Ai]pi ,
что равносильно записи
v=k[A1]P1[A2]P2....[Ai]Pi
Множитель k в этом уравнении называется константой скорости реакции, и он показывает, с какой скоростью протекает химическая реакция при концентрациях реагирующих веществ, равных единице. Из закона действия масс следует, что скорость химической реакции является постоянной величиной только в одном случае, если концентрации реагирующих веществ поддерживаются постоянными. Очевидно, что протекание химической реакции приводит к снижению концентраций реагирующих веществ. Изменение во времени концентрации любого из реагирующих веществ должно приводить к снижению скорости реакции.
Уравнения, описывающие зависимость скорости реакции от концентраций реагирующих веществ, называются кинетическими уравнениями.
Входящую в кинетическое уравнение величина pi принято называть порядком реакции по веществу Ai.
Порядком реакции (р) называют сумму
p=Spi
Аналогичное уравнение может быть записаны и для скорости обратной реакции
v’=k’П[Bj]pj
где k’- константа скорости обратной реакции. Порядок обратной реакции
p’=Sp’j
Порядок реакции не всегда совпадает с так называемой молекулярностью реакции, которая характеризует количество одновременно сталкивающихся молекул реагирующих веществ, в результате чего образуется продукт реакции. Различают простые реакции: мономолекулярные, бимолекулярные и тримолекулярные реакции, которые протекают в одну стадию в результате соударения частиц. Более высокая молекулярность реакций не рассматривается, так как одновременное столкновение 4-х и более частиц считается маловероятным. Для простых реакций вида
SаiAi = SbjBj,
где ai, bj равны 1,2 или 3 порядок реакции по любому компоненту совпадает со стехиометрическим коэффициентом по этому компоненту в уравнении реакции. Если хотя бы один стехиометрический коэффициент в уравнении реакции превышает 3, то это означает, что рассматриваемая реакция не является простой. Подобные реакции называют сложными. Любую сложную реакцию можно представить как последовательность простых реакций. Такая последовательность простых реакций называется механизмом сложной реакции.
Опыт показывает, что с повышением температуры на каждые 10 градусов скорость реакции возрастает примерно в 2-4 раза, что отражается уравнением Вант-Гоффа (1864)
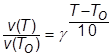
где g- температурный коэффициент реакции (g=2-4).
Более точно зависимость скорости реакции от температуры выражается через зависимость константы скорости k от температуры T с помощью уравнения Аррениуса (1889)
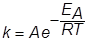
где А-постоянная, ЕА- энергия активации (кДж/моль или ккал/моль) -энергия, которую необходимо затратить для перевода 1 моля вещества в реакционно-спобное состояние, R- газовая постоянная, Т- температура (К).
Логарифмируя уравнение Аррениуса, получаем линейную зависимость ln k от обратной температуры 1/Т
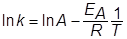
График этой зависимости имеет вид прямой линии, которая на оси ординат отсекает отрезок, равный ln A, а тангенс угла наклона tg a=ЕА/R
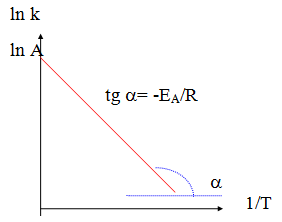
Следовательно, для расчета энергии активации необходимо иметь экспериментальные данные по значениям константы скорости химической реакции при различных температурах.
Физический смысл энергии активации можно пояснить следующим образом. Принимается, что всякая химическая реакция между реагирующими веществами А и В протекает в результате столкновения молекул этих веществ. В реакции, протекающей с конечной скоростью, число столкновений между молекулами, приводящих к химическому взаимодействию, должно быть меньше общего числа столкновений, иначе все реакции протекали бы с очень высокими скоростями. Предполагается, что эффективными столкновениями, приводящими к химической реакции, могут быть такие столкновения, при которых молекулы реагирующих веществ обладают более высоким запасом энергии по сравнению со средней энергией молекул при данной температуре. Поэтому активные молекулы способны преодолеть некий энергетический барьер. Высота этого барьера равна энергии активации.
По вертикальной оси отложена энергия реагирующих молекул, а по горизонтальной оси - координата реакции (путь реакции от исходных веществ к продуктам реакции). На этой схеме через ЕА обозначена энергия активации (высота энергетического барьера) для прямой реакции, а через Е’А- энергия активации для обратной реакции.
Энергия активации это то избыточное количество энергии (по сравнению со средней величиной), которой должны обладать молекулы в момент столкновения, чтобы произошло химическое взаимодействие.
Эта избыточная энергия может быть в молекулах в различной форме:
1) повышенная кинетическая энергия поступательного или вращательного движения молекул;
2) повышенная энергия колебательного движения атомов или атомных групп, составляющих молекулы;
3) повышенная энергия электронов атомов.
При рассмотрении кинетики химических реакции обычно приходится иметь дело с системами, в которых доля активных молекул очень мала и составляет примерно от 10-20 до 10-10 , этим значениям отвечают значения энергии активации от 30 до 15 ккал/моль. Если энергия активации существенно большее 30 ккал/моль, то скорость реакции чрезвычайно мала и реакция в этих условиях практически не идет. Если же энергия активации существенно меньше 15 ккал/моль, то реакция, как правило, происходит практически мгновенно.
Многие реакции протекают очень медленно, если при заданной температуре просто смешать реагирующие вещества, но оказывается их можно значительно ускорить путем введения некоторых других веществ.
Катализом называют изменение скорости реакции, происходящее под действием некоторых веществ, называемых катализаторами, которые, участвуя в процессе, сами к концу реакции остаются химически неизменными.
Катализ принято называть положительным, когда катализатор увеличивает скорость реакции, и отрицательным,- когда катализатор уменьшает скорость реакции. Реакции, которые каталитически ускоряются продуктами, получаемые в этой же реакции, называются автокаталитическими.
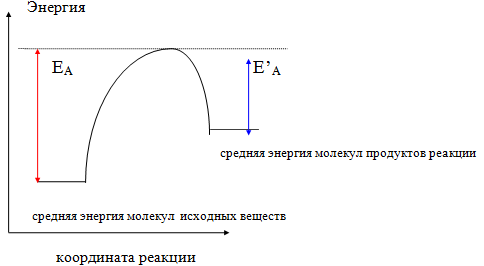
При введении в систему катализатора средняя энергия молекул исходных веществ и продуктов реакции не изменяется, но меняется путь реакции, по которому реакция переходит из начального состояния в конечное, при этом высота энергетического барьера по новому пути оказывается ниже.
"Объединение запросов на взаимодействие" - тут тоже много полезного для Вас.
Катализатор в одинаковой мере понижает энергию активации как прямой, так и обратной реакции. Катализатор не инициирует реакцию, реакция протекает и в его отсутствие, но значительно медленнее, он только ускоряет ее. Катализаторы весьма специфичны - одни реакции они ускоряют, а другие нет.
Если химический процесс является гетерогенным, т.е. протекает на границе двух фаз, то его скорость пропорциональна поверхности раздела двух фаз
v=kSSП[Ai]S pi ,
где kS- константа скорости гетерогенной реакции, S- суммарная поверхность раздела фаз, [Ai]S -объемная концентрация реагирующего вещества на границе раздела фаз. Поэтому при проведении подобных процессов стараются различными способами, например, дробления, максимально увеличить соприкосновение двух фаз. Известно, что воздушная каменноугольная смесь является взрывоопасной, тогда как та же масса угля в виде сплошного куска безопасна.
Особенности кинетики гетерогенных реакций заключаются также в том, что их скорости зависят от концентраций реагирующих веществ на поверхности раздела двух фаз, которые вследствие медленного подвода их к поверхности могут сильно отличаться от объемных концентраций. В этом случае скорость процесса зависит от интенсивности перемешивания реагирующих веществ.






















