Слабые электролиты. Степень диссоциации
Слабые электролиты. Степень диссоциации
Процесс диссоциации слабых электролитов является обратимым. Для электролита вида АВ процесс диссоциации можно записать так:
АВ ↔А+ + В-
Слабые электролиты подчиняются закону действующих масс, поэтому равновесие может количественно характеризоваться константой равновесия, называемой в данном случае константой диссоциации. Эта константа выразится соотношением
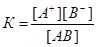
Константа диссоциации может достаточно корректно характеризовать лишь разбавленные растворы слабых электролитов. Для концентрированных растворов слабых электролитов используется степень диссоциации электролита a - величина, показывающая какая часть молекул электролита в растворе распалась на ионы:
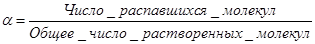
Значение a всегда меньше единицы. Умножая a на 100, получают долю ионизированных молекул в процентах.
Степень диссоциации связана с константой диссоциации. Так, для бинарного электролита АВ концентрации ионов [А+] и [В+] связываются с общей концентрацией электролита С соотношением:
Рекомендуемые материалы
Если [А+] = [В+] = aС, и Сав=(1-a)С
Тогда
Кд = a2С/(1-a) – Закон разбавления Оствальда
"18 Приложение" - тут тоже много полезного для Вас.
Степень диссоциации зависит от природы электролита, природы растворителя, температуры раствора и степени его разбавления. Чем больше диэлектрическая постоянная растворителя, тем значительнее электролитическая диссоциация растворенного в нем вещества. Диссоциация молекул — процесс эндотермический, поэтому, по принципу Ле-Шателье с повышением температуры степень диссоциации должна возрастать. Однако при повышении температуры уменьшается диэлектрическая постоянная растворителя, что благоприятствует образованию неионизированных молекул. У большинства электролитов степень диссоциации по мере повышения температуры увеличивается, достигает максимума и затем уменьшается.
С разбавлением раствора электролита вероятность взаимодействия ионов в растворе уменьшается, степень электролитической диссоциации увеличивается.
Экспериментальные данные свидетельствуют, что растворы электролитов обнаруживают всегда большие отклонения от свойств чистого растворителя, чем растворы не электролитов. Отклонения определяются степенью диссоциации слабого электролита. Поэтому в уравнения вводятся поправочный коэффициент – изотонический коэффициент I:
Изотонический коэффициент показывает, во сколько раз суммарная эффективная концентрация недиссоциированных молекул и ионов больше, чем концентрация молекул до диссоциации.
Тогда a = (i-1)/(n-1)
Где n – число ионов, на которые способна дислоцировать молекула.





















