Электрохимические элементы
Глава 10. Электрохимические элементы
10.1. Классификация электродов
Электрод – проводник, погруженный в электролит. Каждый электролит характеризуется электродным межфазным потенциалом – разностью напряжений между электродом и электролитом.
Электроды первого рода – системы, у которых значение электродных потенциалов зависит от активности окисленной (или восстановленной) формы. Например, Ag помещенный в раствор AgNO3 : на электроде происходит реакция
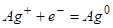
К электродам первого рода относится также водородный электрод: черненая платина, погруженная в раствор кислоты и обдуваемая потоком газообразного водорода. На электроде происходит реакция
 (газ)
(газ)
Потенциал водородного электрода, у которого активность ионов водорода равна единице и летучесть газообразного водорода равна 1 бар, принимается на нуль отсчета стандартных электрохимических потенциалов (нормальный водородный электрод, НВЭ). Принята следующая запись для электродов первого рода: Mn+,M0 или Mn+|M0, где Mn+ - окисленная форма (Ox), M0 – восстановленная форма (Red) вещества электрода.
Электроды второго рода – системы, у которых значение электродных потенциалов не зависит от активности окисленной и восстановленной формы металла, а определяется активностью анионов, не принимающих участие в окислительно-восстановительных превращениях. Такие электроды состоят из металла, покрытого его труднорастворимой солью и погруженного в раствор, содержащий анионы этой соли. Например, хлорсеребрянный электрод, который представляет собой металлическое серебро, покрытое осадком хлорида серебра и погруженное в раствор, содержащий анионы хлора. На этом электроде происходит окислительно-восстановительная реакция
Рекомендуемые материалы
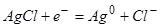
Для электродов второго рода принята запись M0,MnXm,X -
Электроды третьего рода – системы, у которых значение электродного потенциала не зависит от активности окисленной и восстановленной формы, а определяется активностью катиона в растворе. Этот электрод состоит из металла, на котором осажены две труднорастворимые соли. Например, серебро, покрытое сначала хлоридом серебра, а затем хлоридом цинка; электрод погружен в раствор PbNO3 . На этом электроде идет процесс
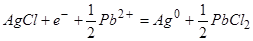
Для электродов третьего рода принята запись 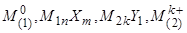
Встречаются окислительно-восстановительные электроды, значение электродного потенциала которых зависит от активности окисленной и восстановленной формы ионов в растворе. Этот электрод состоит обычно из инертного металла (платина, палладий, и т.д.), погруженного в раствор, содержащий ионы как высшей, так и низшей форм окисления. Например,
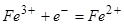
При обозначении окислительно-восстановительного электрода указывают на природу нейтрального металла в виде Ox, Red (Pt). Например  .
.
10.2. Механизм образования электродных потенциалов
Рассмотрим водородный электрод
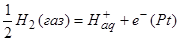
При этом металлическая платина заряжается отрицательно, а раствор – положительно. H+ , покидая платину, совершает работу против электрических сил. В равновесии
 (10.1)
(10.1)
где  - химический потенциал электрона в платине. Раскрывая это выражение, получим
- химический потенциал электрона в платине. Раскрывая это выражение, получим
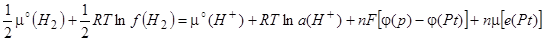
где  и
и  - электрический потенциал раствора и платинового электрода, соответственно;
- электрический потенциал раствора и платинового электрода, соответственно;  - летучесть газообразного водорода;
- летучесть газообразного водорода;  - активность катионов водорода в растворе; n – заряд протона или число электронов, участвующих в реакции; F – число Фарадея (F = eNa = 96485 Кл/моль). Для разности потенциалов находим
- активность катионов водорода в растворе; n – заряд протона или число электронов, участвующих в реакции; F – число Фарадея (F = eNa = 96485 Кл/моль). Для разности потенциалов находим
 (10.2)
(10.2)
где
 (10.3)
(10.3)
представляет собой стандартный электродный потенциал водородного электрода, принимаемый равным нулю для указанных выше стандартных условий. Величину
 (10.4)
(10.4)
называют потенциалом полуэлемента, или электродным потенциалом. Эту величину записывают в общем виде
 (10.5)
(10.5)
10.3. Напряжение гальванического элемента
Гальванический элемент – два электрода, соединенные проводником. Напряжение гальванического элемента – это предельное значение разности электродных потенциалов, при токе через элемент, стремящемся к нулю.
Например, гальванический элемент из двух электродов первого рода:
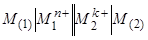
Исходя из общей формулы (10.5), запишем выражения для потенциалов обоих электродов:
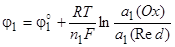
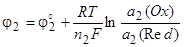
Напряжение гальванического элемента:
 (10.6)
(10.6)
где
 (10.7)
(10.7)
Величину E0 называют стандартной разностью электродных потенциалов:
 (10.8)
(10.8)
Уравнение (10.6) называется уравнением Нернста.
10.4. Распределение и потоки ионов через мембрану
Движение ионов через полупроницаемую мембрану может привести к возникновению разности электрических потенциалов на мембране, из за разной проницаемости мембраны для разных ионов. Эта разность потенциалов влияет на равновесное распределение других ионов, переносимых через мембрану.
Рассмотрим раствор, содержащий ионы X+ и Y -, разделенный мембраной на две части (1) и (2), каждая из которых характеризуется концентрациями ионов и своим электрическим потенциалом: ( ,
, ,
, ) и (
) и ( ,
, ,
, ). Выпишем выражения для химического потенциала катиона в первой и во второй части системы:
). Выпишем выражения для химического потенциала катиона в первой и во второй части системы:
 (10.9)
(10.9)
 (10.10)
(10.10)
В равновесии выполняется равенство химических потенциалов:

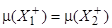
Бесплатная лекция: "17 Недостатки экологической экспертизы как инструмента экологической политики" также доступна.
откуда следует, что
 (10.11)
(10.11)
Аналогично, для аниона  :
:
 (10.12)
(10.12)
Сравнивая уравнения (10.11) и (10.12), получаем
 (Доннаново равновесие) (10.13)
(Доннаново равновесие) (10.13)




















