Растворы
Растворы
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в широких пределах.
Наиболее важный вид растворов – жидкие растворы.
Всякий раствор состоит из растворенных веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор. Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (спирт, вода), то растворителем считается компонент, находящийся в большем количестве. Отличие растворов от химических соединений состоит в том, что состав раствора может меняться в широких пределах. Кроме того, в свойствах раствора проявляются многие свойства отдельных компонентов, чего не наблюдается в случае химических соединений. Непостоянство состава приближает растворы к механическим смесям, но от последних растворы отличаются однородностью. Они занимают промежуточное положение.
Растворение кристалла в жидкости происходит следующим образом. Когда вносят кристалл в жидкость, в которой он может раствориться, от поверхности его отрываются отдельные молекулы, которые благодаря диффузии распределяются по всему объему растворителя. Отделение молекул от поверхности твердого тела объясняется их собственным колебательным движением, а также притяжением со стороны растворителя. Этот процесс должен бы продолжаться до полного растворения любого кристалла, если бы одновременно не происходил обратный процесс – кристаллизация. Перешедшие в раствор молекулы, ударяясь о поверхность еще не растворившегося вещества, притягиваются к нему и входят в состав кристаллов. Наконец, наступает момент, когда скорость растворения становится равной скорости кристаллизации, тогда устанавливается динамическое равновесие, при котором в единицу времени столько же молекул растворяется, сколько и выделяется из раствора.
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором.
Способы выражения концентрации растворов.
Концентрацией раствора называется содержание растворенного вещества в определенных массе или объеме раствора или растворителя.
Чаще всего для выражения концентрации растворов используются следующие способы.
Рекомендуемые материалы
Массовая доля – число граммов растворенного вещества в 100 г раствора.
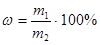
Молярная концентрация – число моль растворенного вещества на 1 литр раствора
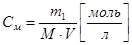
Эквивалентная (нормальная) концентрация – число моль эквивалентов растворенного вещества на 1 литр раствора.
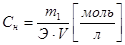
Титр раствора – число граммов растворенного вещества, содержащихся в 1 мл раствора.
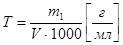
Все эти способы выражения концентрации связаны между собой следующим уравнением:
 , где
, где
m1 – масса растворенного вещества, г,
m2 – масса раствора, г.
M – молярная масса, г/моль,
V – объем раствора , л.
Э – молярная масса эквивалентов, г/моль,
ρ - плотность раствора, г/см3.
Гидраты и кристаллогидраты.
Большинство веществ, находящихся в кристаллическом состоянии, растворяются в жидкостях с поглощением теплоты. Но при растворении некоторых веществ температура раствора повышается.
Изменение энтальпии при растворнии одного моля вещества называется энтальпией растворения этого вещества (ΔН).
Процесс растворения сопровождается значительным возрастанием энтропии, ∆S>0, т.к. в результате равномерного распределения частиц одного вещества в другом резко возрастает число макросостояний системы. Поэтому, несмотря на то, что для большинства кристаллов ∆Н>0, ΔG<0 из-за большого значения энтропийного фактора – и процесс растворения самопроизвольный.
При растворении кристаллов происходит их разрушение, что требует затраты энергии, поэтому растворение должно сопровождаться поглощением теплоты. Если же наблюдается обратный эффект, то это показывает, что происходит взаимодействие между растворителем и веществом, при котором выделяется энергия.
Установлено, что при растворении многих веществ их молекулы или ионы связываются с молекулами растворителя, образуя сольваты (гидраты). Этот процесс называется сольватация или гидратация. Подтверждением химизма растворения служит тот факт, что многие вещества выделяются из растворов в виде кристаллов, содержащих кристаллизационную воду. Это кристаллогидраты, а вода в них – кристаллизационная.
Процесс образования гидратов протекает с выделением теплоты. При растворении вещества, подвергающегося гидратации, общий тепловой эффект складывается из теплового эффекта разрушения кристаллической решетки твердого растворяемого вещества и теплового эффекта гидратации. Первый процесс – эндотермический, а второй – экзотермический. Общий тепловой эффект процесса, равный алгебраической сумме тепловых эффектов двух стадий, может быть больше нуля или меньше нуля.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях служит содержание его в насыщенном растворе. Чаще всего растворимость – это число граммов вещества, насыщающего при данных условиях 100г растворителя (коэффициент растворимости). При этом, если в 100г воды растворяется более 10г вещества, то такое вещество принято считать хорошо растворимым, если растворяется менее 1г вещества – малорастворимым и, наконец, практически нерастворимым, если в раствор переходит менее 0,01г вещества.
Растворение сопровождается выделением или поглощением тепла, следовательно, повышая или понижая температуру можно менять растворимость, согласно принципу Ле Шателье.
При растворении твердых тел в воде объем системы изменяется незначительно, поэтому растворимость твердых веществ практически не зависит от давления.
Растворимость большинства веществ уменьшается с понижением температуры, поэтому при охлаждении горячих насыщенных растворов избыток растворенного вещества обычно выделяется. Однако, если производить охлаждение осторожно и медленно, то выделения его из раствора может не произойти. В этом случае получится раствор, содержащий значительно больше растворенного вещества, чем его требуется для наыщения при данной температуре. Такие растворы называются пересыщенными. В спокойном состоянии они могут оставаться без изменения длительное время. Но стоит только бросить в такой раствор кристаллик того вещества, которое в нем растворено, как тотчас же вокруг него начинают расти другие кристаллы и через короткое время весь избыток растворенного вещества выкристаллизовывается.Иногда кристаллизация начинается от простого сотрясения раствора. При кристаллизации выделяется значительное количество теплоты.
Следовательно, пересыщенные растворы являются неустойчивыми системами, способными к существованию только при отсутствии в системе твердых частиц растворенного вещества.
Растворение газов в воде представляет собой экзотермический процесс. Поэтому растворимость газов с повышением температуры уменьшается. Если оставить в теплом помещении стакан с холодной водой, то внутренние стенки его покроются пузырьками газа – это воздух, который был растворен в воде, выделяется из нее вследствие нагревания. Кипячением можно удалить из воды весь растворенный в ней воздух ( деаэрация). Однако растворение газов в некоторых органических жидкостях сопровождается поглощением теплоты; в подобных случаях растворимость газов с ростом температуры увеличивается. Поглощение теплоты в данном случае происходит из-за того, что энергия межмолекулярного притяжения между молекулами растворителя оказывается по модулю больше, чем энегрия притяжения между молекулами газа и растоврителя в растворе. Растворение происходит за счет увеличения энтропии системы, а молекулы газа, “внедряясь” между молекулами растворителя, затрачивают энергию на разрыв сил сцепления молекул жидкости между собой. Такие процессы возможны между веществами, резко отличающимися по своей природе: неполярным газом и полярной жидкостью и т.п.
При растворении газа в жидкости устанавливается равновесие:
Газ + Жидкость ↔ Насыщенный раствор газа в жидкости
При этом объем системы существенно уменьшается. Следовательно, повышение давления должно приводить к смещению равновесия вправо, т.е. к увеличению растворимости газа.
К этому же выводу можно прийти, исходя из динамического характера равновесия между газом и его раствором в жидкости. Молекулы газа, находящиеся над жидкостью в закрытом сосуде, бомбардируют поверхность жидкости и растворяются в жидкости со скоростью, пропорциональной концентрации газ. Перешедшие в раствор молекулы в свою очередь время от времени ударяются о поверхность жидкости изнутри и вылетают наружу. По мере того как в результате растворения концентрация растворенных молекул будет увеличиваться, скорость их выделения тоже будет расти, пока, наконец, не сравняется со скоростью растворения. В результате установится состояние равновесия, т.е. жидкость станет насыщенной газом.
Если теперь увеличить давление газа, например, в 2 раза, то востолько же раз увеличится и концентрация его молекул над жидкостью, а следовательно, и скорость растворения газа. Равновесие нарушится. Чтобы при новом давлении снова установилось равновесие, концентрация растворенных молекул тоже должна увеличиться вдвое. Таким образом, приходим к выводу, который известен под названием закона Генри:
масса газа, растворяющегося при постоянной температуре в данном объемежидкости, прямо пропорциональна парциальному давлению газа.
ωВ = k·p,
где ωВ – массовая доля газа в насыщенном растворе; р – парциальное давление газа; k – коэффициент пропорциональности, называемый констаной Генри.
Следствие закона Генри: объем газа, растворяющегося при постоянной температуре в данном объеме жидкости, не зависит от его парциального давления.
Газы подчиняются закону Генри при не очень высоких давлениях и лишь в случае, когда онине вступают в химическое взаимодействие с растворителем. При высоких давлениях отклонения от закона Генри наблюдаются и при растворении химически не взаимодействующих с растворителем газов.
Растворы электролитов.
В предыдущей лекции мы познакомились с законами, которым подчиняются разбавленные растворы. Справедливость этих законов подтверждается результатами многих экспериментов. Однако имеются вещества, растворы которых сильно отклоняются от всех рассмотренных законов. К подобным веществам относятся соли, кислоты и щелочи. Водные растворы этих веществ обладают еще одной особенностью – они проводят электрический ток. С. Аррениус (1887г.) обратил внимание на тесную связь между способностью растворов солей, кислот и оснований проводить электрический ток и отклонениями растворов этих веществ от законов Рауля и Вант-Гоффа. Аррениус предположил, что при взаимодействии растворимого вещества с растворителем происходит ионизация частиц растворяемого вещества.
Распад вещества на сольватированные ионы под действием молекул растворителя называется электролитической диссоциацией.
Вещества, которые при растворении образуют заряженные частицы, называются электролитами (это проводники электрического тока второго рода, а проводники электрического тока первого рода – металлы). Их делят на сильные и слабые электролиты.
К сильным электролитам относят: кислоты -
HCl, HNO3, H2SO4, HСlO4, гидроксиды щелочных и щелочноземельных металлов, все растворимые в воде соли.
К слабым электролитам относятся: органические кислоты, минеральные кислоты: HCN, H2S,H3PO4 и др. плохо растворимые в воде основания и соли.
Способность к электролитической диссоциации зависит не только от самого электролита, но и от растворителя.
По закону Кулона электростатическое притяжение (F) двух разноименных зарядов (e1 и е2), расстояние между которыми r
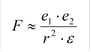 |
 |
e – диэлектрическая проницаемость среды – показывает во сколько раз силы взаимодействия между зарядами в данной среде меньше, чем в вакууме, т.е. чем больше диэлектрическая проницаемость среды, тем слабее взаимодействуют между собой частицы, тем вероятнее произойдет ионизация молекул.
Самой высокой диэлектрической проницаемостью обладает вода. Именно поэтому в водной среде максимально ослабляется электростатическое притяжение разноименно заряженных ионов. В растворителях с малой диэлектрической проницаемостью ионы продолжают достаточно сильно притягиваться друг к другу, оставаясь в виде ионных пар. Большая диэлектрическая проницаемость воды не является единственной причиной ее высоеого ионизирующего действия. Дипольный характер молекул воды, обладающих неподеленными электронными парами, обусловливает ее значительную спосоьность к образованию гидратированных ионов за счет донорно-акцепторного взаимодействия, а выделяющаяся при этом энергия гидратации ионов компенсирует энергию, необходимую для преодоления сил электростатического притяжения ионов в кристаллической решетке вещества.
Сильные электролиты
Для сильных электролитов характерна полная диссоциация на ионы в растворе:
AB = A++B-.
В растворе образуются гидратированные ионы вещества. Между заряженными частицами существует электростатическое взаимодействие.
Активность иона:
a = f×c,
где a – активность иона,
c - молярная концентрация, моль/л
f - коэффициент активности, л/моль
Активность – это доля общего числа ионов, которая влияет на электрическую проводимость раствора, давление пара, температуру кристаллизации, кипения и другие свойства раствора. Активность зависит не только от концентрации одного иона, но и от концентрации других ионов, находящихся рядом. Чтобы учесть влияние других ионов, находящихся рядом, вводят понятие ионная сила растворов (m).
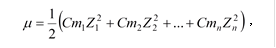
где Cm – моляльные концентрации ионов (это количество молей растворенного вещества в одном литре растворителя), Z – заряд иона.
Пример: Вычислить ионную силу 0,01М раствора Ca(NO3)2 , к 1л которого добавили 0,05моль NaCl .
Ca(NO3)2 ® Ca2+ + 2NO3-;
0,01 0,02
NaCl ® Na+ + Cl-
0,05 0,05
[Ca2+] = 0,01; [NO-3] = 0,02; [Na+] = 0,05; [Cl-] = 0,05
m = 1/2(0,01×22 + 0,02×12 +0,05×12 + 0,05×12) = 0,08
При одной и той же ионной силе m коэффициент активности f зависит от заряда иона. Ионы с высоким зарядом обладают повышенной способностью к образованию ионных ассоциатов, поэтому их коэффициент активности снижается. В разбавленных растворах с одинаковой ионной силой коэффициенты активности ионов, обладающих одинаковыми зарядами, примерно одинаковы.
Пример: Вычислить ионную силу раствора и активность ионов меди в 0,025M растворе CuSO4.
CuSO4 = Cu2+ + SO42-
m = 1/2×(0,025×22 + 0,025×22) = 0,1
f = 0,33 – из таблицы
a(Cu2+ )= a(SO42- ) = 0,33×0,025 = 8,25×10-3
Для очень разбавленных растворов зависимость коэффициента активности от ионной силы раствора выражается уравнением Дебая-Гюккеля:
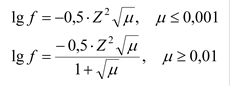 |
Слабые электролиты
Слабые электролиты не полностью диссоциированы в растворе. Существует равновесие между диссоциированной частью и недиссоциирующими молекулами:
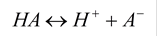 |
Так как в растворах слабых электролитов концентрации ионов невелики, для расчетов мы можем пользоваться концентрацией ионов, а не их активностью.
Степень диссоциации слабого электролита a - это отношение числа распавшихся на ионы молекул к общему числу молекул:
 |
Степень диссоциации зависит от природы электролита и растворителя, от концентрации и от температуры.
Как для всякой обратимой реакции, для уравнения электролитической диссоциации слабого электролита мы можем написать выражение для константы равновесия:
 , которая является константой электролитической диссоциации.
, которая является константой электролитической диссоциации.
Константа электролитической диссоциации не зависит от концентрации вещества, а зависит только от температуры и природы веществ.
Если концентрация [HA] = C, то [H+] = [A-] = Cα
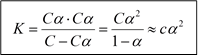 |
Для растворов с небольшой концентрацией a < 0,1 и К » Сa2, тогда  - это выражение - закон разбавления Оствальда или закон действующих масс для растворов слабых электролитов. Согласно этому закону при разбавлении раствора (уменьшении концентрации) степень диссоциации увеличивается. Степень диссоциации увеличивается также и при увеличении температуры раствора.
- это выражение - закон разбавления Оствальда или закон действующих масс для растворов слабых электролитов. Согласно этому закону при разбавлении раствора (уменьшении концентрации) степень диссоциации увеличивается. Степень диссоциации увеличивается также и при увеличении температуры раствора.
Расчет концентрации ионов водорода в растворе слабой кислоты.
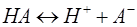
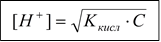
 , так как [H+] = [A-], то получаем
, так как [H+] = [A-], то получаем 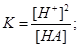
В растворе слабого основании аналогично 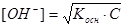
Вода. Водородный показатель.
Вода является весьма слабым электролитом, ее диссоциация выражается уравнением
H2O « H+ + OH-
H+ + H2O « H3O+
Свободных ионов водорода в воде нет.
[H2O] = C исх
С исх = 1000г/18г = 55,55 моль/л. – концентрация воды.
Кравн. × [H2O] = const = [H+]×[OH-] = 1,8×10-16×55,55 = 1×10-14
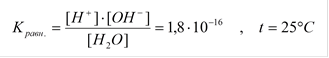 |
т.е. [H+]×[OH-] = 1×10-14 = Kw - ионное произведение воды.
В любом растворе присутствуют как ионы водорода, так и ионы гидроксила, но в разных количествах.
Нейтральная среда:

Кислая среда:
[H+] > 10-7 , т.е. [H+] = 10-6; 10-5
[OH-] = 10-8; 10-9
Щелочная среда:
[H+] < 10-7 , т.е. [H+] = 10-8; 10-9;10-10
[OH-] = 10-6; 10-5; 10-4
Водородный показатель среды:
pH = - lg[H+]; pOH = - lg[OH-]
В нейтральной среде: pH = 7 = pOH.
В кислой среде: pH < 7; pOH > 7.
В щелочной среде: pH > 7; pOH < 7.
pOH = 14 – pH
Ионное произведение воды зависит от температуры, так как степень диссоциации воды зависит от температуры.
При t = 0°; Kw = 0,114×10-14
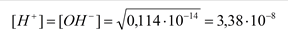 |
pH = - lg[H+] = 7,47; т.е. при 0° - pH нейтральной среды > 7.
При t = 50°
 [H+]×[OH-] =5,47×10-14
[H+]×[OH-] =5,47×10-14
pH = 6,63
Пример 1:
Расчет водородного показателя:
См = 0,1 М
Ккисл = 1,8×10-4

Вычислить pH в водном растворе муравьиной кислоты:
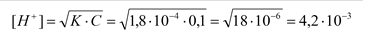 |
pH = - lg 4,2×10-3 = 2,38 – кислая среда.
Для слабых электролитов можно использовать концентрацию ионов, а не понятие активности.
Пример 2:
Вычислить рН в 0,25М растворе хлорной кислоты.
Хлорная кислота – сильный электролит, следовательно для расчетов нужно использовать активность ионов , а не концентрацию.
HClO4 = H+ + ClO4-
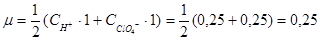
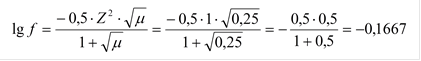 |
f = 0,681.
аH+ = f×[H+] = 0,25×0,681 = 0,17
pH = - lg0,17 = 0,77 – очень кислая среда.
Гидролиз солей.
Гидролиз – это взаимодействие веществ с водой.
Гидролиз можно охарактеризовать степенью гидролиза: h
 |
Степень гидролиза зависит
- от природы соли и выражается константой гидролиза,
- от концентрации,
- от температуры (чем выше температура, тем больше степень гидролиза).
Соли полнлстью, необратимо диссоциируют в растворе на ионы. При этом, если соль образована сильным основанием и сильной кислотой, то образованные в растворе ионы не вступают во взаимодействие с водой и не образуют с ней сложных веществ. Концентрация ионов гидроксила и ионов водорода не меняется, т.е. pH » 7 (среда нейтральная).
Пример: NaCl = Na+ + Cl- - это не гидролизующиеся соли.
1). Рассмотрим соли, образованные слабой кислотой и сильным основанием:
NaNO2, CH3COONa, HCOOK (формиат калия), Na3PO4
CH3COONa = CH3COO- + Na+
С водой будет взаимодействовать анион слабой кислоты
CH3COO- + H2O « CH3COOH + OH- (накапливаются ионы гидроксила).
В растворах этих солей pH > 7 (среда щелочная).
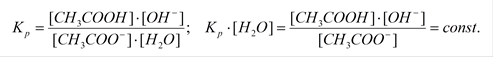 | |||
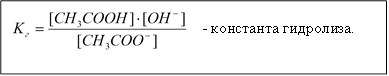 |
Равновесие гидролиза характеризуется константой гидролиза. Подставим в это выражение концентрацию ионов гидроксила, выраженную через ионное произведение воды:
В этом уравнении  , отсюда получаем
, отсюда получаем
 - константа гидролиза соли, образованной слабой кислотой и сильным основанием
- константа гидролиза соли, образованной слабой кислотой и сильным основанием
Расчет степени гидролиза:
c - ch ch ch
CH3COO - + H2O « CH3COOH + OH -
c – исходная концентрация соли;
h – степень гидролиза;
ch – концентрация прогидролизовавшихся молекул.
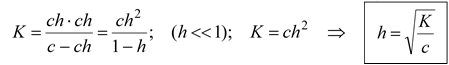 |
Расчет рН среды:
A - +H2O « HA + OH - ; (A – анионы кислоты)
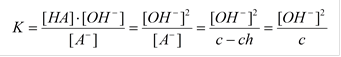
[HA] = [OH-] (h<<1)
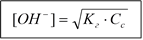 |
[OH-]×[H+] = 10-14 pOH = - lg[OH-] (pH = 14 – pOH).
2). Рассмотрим соли, образованные сильной кислотой и слабым основанием:
NH4OH, NH4Cl, NH4NO3, CuSO4
NH4Cl = NH4+ + Cl-
NH4+ +H2O « NH4OH + H+
В растворах этих солей pH < 7 (среда кислая).
Напишем выражение для константы равновесия этой реакции:
 ,
, 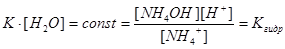
Подставив в это уравнение выражение для [H+] через ионное произведение воды, получаем
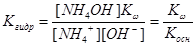
 |
Степень гидролиза:
Расчет рН раствора:
c - ch ch ch
NH4+ + H2O « NH4OH + H+
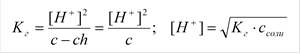 |
Пример: рассчитать степень гидролиза нитрата аммония и pH раствора, где См=0,1моль/л,
Кг. = Кω/Косн. = 10-14/1,76×10-5 = 5,7×10-10 (константа гидролиза)
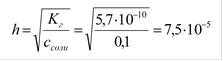 | |||||
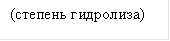 | |||||
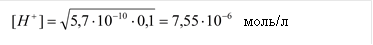 |
pH = - lg 7,55 ×10 –6 = 5,1
3). Соли, образованные слабым основанием и слабой кислотой:
CH3COONH4 (ацетат аммония), NH4CN (цианид аммония), NH4HCOO (формиат аммония).
CH3COONH4 = CH3COO - + NH4+
c – ch c – ch ch ch
CH3COO -+ NH4+ + H2O « CH3COOH + NH4OH
В растворах этих солей pH » 7 (среда нейтральная).
Если же константы диссоциации кислоты и основания сильно различаются, среда не будет нейтральной, например:
NH4CN + H2O « NH4OH + HCN
К(NH4OH) = 10-5; K(HCN) = 6,2×10-10
Гидролиз будет идти сильнее по аниону:
 NH4+ + H2O « NH4OH + H+ [OH-] > [H+]
NH4+ + H2O « NH4OH + H+ [OH-] > [H+]
CN- + H2O « HCN + OH-
Напишем выражение для константы равновесия гидролиза ацетата аммония:
 , здесь
, здесь  , тогда, умножив и разделив константу гидролиза на ионное произведение воды, получаем:
, тогда, умножив и разделив константу гидролиза на ионное произведение воды, получаем:
 или
или
 , откуда
, откуда
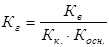
Расчет степени гидролиза:

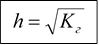 |
Расчет рН:
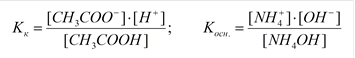 |
Kк. ~ [H+]; Kосн. ~ [OH-]
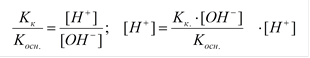 | |||
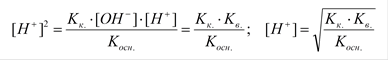 |
Смещение равновесия гидролиза
1. 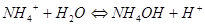
По принципу Ле-Шателье уменьшение концентрации ионов водорода сместит равновесие вправо, т.е. усилит гидролиз. Чтобы усилить гидролиз, нужно добавить сильную щелочь, связывающую ионы водорода.
Добавление ионов водорода (кислоты) – подавляет гидролиз, смещая равновесие гидролиза влево.
Ещё посмотрите лекцию "Понятие политического режима в политологии" по этой теме.
2. 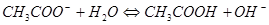
Добавление сильной кислоты (Н+) сместит равновесие гидролиза вправо, так как при этом будут связываться ионы гидроксила. Добавление щелочи подавляет гидролиз.
3. Гидролиз проходит до конца, если в результате получаются не растворимые в воде соединения и газы.
Например:
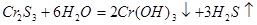
Соли, образованные многозарядными катионами (Cr3+, Fe3+, Al3+) и очень слабыми кислотами (угольной, сернистой, сероводородной, кремниевой) – в водном растворе не существуют, так как подвергаются необратимому гидролизу.
















