Понижение давления насыщенного пара над раствором. Осмос
4.3. Понижение давления насыщенного пара над раствором. Осмос
К общим свойствам растворов относятся: понижение давления насыщенного пара растворителя над раствором, температура замерзания, осмос.
Закон Рауля: молекулы нелетучего растворенного компонента раствора препятствуют улетучиванию из раствора молекул растворителя.
Понижение давления насыщенного пара растворителя над раствором пропорционально концентрации растворенного нелетучего вещества.
Следствия из закона Рауля:
1) температура кипения раствора выше температуры кипения растворителя;
2) температура замерзания (кристаллизации) раствора ниже температуры замерзания (кристаллизации) чистого растворителя.
Осмотическое давление. Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества, называется осмосом. Осмос обусловлен диффузией молекул растворителя через полупроницаемую перегородку, которая пропускает только молекулы растворителя. Молекулы растворителя диффундируют из растворителя в раствор или из менее концентрированного раствора в более концентрированный, поэтому концентрированный раствор разбавляется, при этом увеличивается и высота его столба. Количественно осмос характеризуется осмотическим давлением, равным силе, приходящейся на единицу площади поверхности и заставляющей молекулы растворителя проникать через полупроницаемую перегородку. Оно равно давлению столба раствора в осмометре высотой h. При равновесии внешнее давление уравновешивает осмотическое давление. В этом случае скорости прямого и обратного переходов молекул через полупроницаемую перегородку становятся одинаковыми. Если внешнее давление р, приложенное к более концентрированному раствору, выше осмотического p, т. е. р > p, то скорость перехода молекул растворителя из концентрированного раствора будет больше, и растворитель будет переходить в разбавленный раствор (или чистый растворитель). Этот процесс, называемый обратным осмосом, используется для очистки природных и сточных вод, для получения питьевой воды из морской. Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры. Я. X. Вант-Гофф предположил, что для осмотического давления можно применить уравнение состояния идеального газа:
 (4.6)
(4.6)
Рекомендуемые материалы
откуда
p = с(вещества)×R×Т, (4.7)
где p — осмотическое давление;
с - молярная концентрация вещества в растворе.
Осмотическое давление зависит от концентрации раствора и температуры, но не зависит от природы растворенного вещества и природы растворителя.
Осмос играет очень важную роль в биологических процессах, обеспечивая поступление воды в клетки и другие структуры. Растворы с одинаковым осмотическим давлением называются изотоническими. Если осмотическое давление выше внутриклеточного, то оно называется гипертоническим, если ниже внутриклеточного - гипотоническим. Например, среднее осмотическое давление крови при температуре 309 К равно 780 кПа.
Гипертонические растворы сахара (сироп) и соли (рассол) широко применяются для консервирования продуктов, так как вызывают удаление воды из микроорганизмов.
Активность. Законы Рауля и Вант-Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов. По мере повышения концентрации растворенного вещества возрастают отклонения от законов идеальных растворов. Эти отклонения обусловлены различного рода взаимодействиями между частицами растворенного вещества, а также растворенного вещества и растворителя. Учет влияния на свойства растворов этих взаимодействий очень сложен и не всегда практически осуществим. Поэтому было предложено сохранить для описания свойств растворов все общие закономерности, применимые к идеальным растворам, но вместо входящих в них концентраций компонентов ввести активности. Активность а связана с концентрацией следующим соотношением:
а = γ × с{вещества), (4.8)
где γ - коэффициент активности, который формально учитывает все виды взаимодействия частиц в данном растворе, приводящие к отклонению от свойств идеального раствора.
Приготовление растворов
Пример 1. Какие массы хлорида натрия и воды нужно взять, чтобы приготовить 1 кг раствора с массовой долей соли 5 %?
Решение. Вариант I
В 100 г раствора должно быть 5 г NaCl,
в 1000 г раствора должно быть х г NaCl.
Откуда 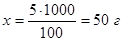
Если соли нужно 50 г, то воды 1000 - 50 = 950 г.
Вариант II
Из выражения (4.1) находим массу вещества:
т(вещества) = w×m(pacmвopa), т(вещества) = 1000×0,05 = 50 г.
Из выражения (4.2) находим массу растворителя (воды):
т(растворителя) = т{раствора) - т(вещества);
т(растворителя) = 1000 - 50 = 950 г.
Ответ: 50 г соли и 950 г воды.
Пример 2. Какая масса воды необходима для растворения 108 г соли, чтобы получить раствор с массовой долей соли 30 %?
Решение. Вариант I
В 100 г раствора должно быть 30 г соли, в х г раствора должно быть 108 г соли. Откуда
 .
.
Значит, воды нужно 360 - 108 = 252 г.
Вариант II
Из выражения (4.1) находим массу раствора:
т(раствора) = ; т(раствора) =
; т(раствора) =  = 360 г.
= 360 г.
Из выражения (4.2) находим массу растворителя (воды):
т{растворителя) = т(раствора) — т{вещества);
т(растворителя) = 360 — 108 = 252 г.
Ответ: 252 г воды.
Разбавление растворов
Пример 3. К 300 см3 раствора (р = 1,07 г/см3) с массовой долей H2SO4 10 % добавили 180 г воды. Какой стала массовая доля кислоты в полученном растворе?
Решение. Находим массу раствора:
т{раствора) = V(pacтвopa) × p,
m(pacmвopa) = 300×1,07 = 321 г.
Из выражения (4.1) находим массу вещества:
т(вещества) = w×m(pacmвopa);
т(вещества) = 321× 0,1 = 32,1 г.
Масса раствора после добавления воды составила
321 г + 180 г = 501 г.
Подставляя полученные значения в уравнение, выражающее массовую долю, получим:
 .
.
Ответ: массовая доля H2SO4 в растворе 6,4 %.
Пример 4. Какую массу столового уксуса, в котором массовая доля СНзСООН 9 %, можно приготовить из 90 г уксусной эссенции с массовой долей СН3 СООН 80 %?
Решение. Из выражения (4.1) находим массу вещества уксусной кислоты:
т{вещества) — w2(вещества) × т(раствора)2,;
т{вещества) = 90 × 0,8 = 72 г.
Учитывая, что масса вещества в первом и втором растворах одинакова, из выражения (4.1) находим массу раствора уксусной кислоты (9 %):
т(раствора)= = 800 г.
= 800 г.
Ответ: 800 г.
Укрепление растворов. Раствор можно укрепить, т. е. повысить массовую долю растворенного вещества разными способами. Например, добавить определенное количество растворенного вещества, или прибавить более концентрированный раствор, или подвергнуть упариванию.
Пример 5. 200 г водного раствора с массовой долей КС1 15 % упарили. Определите:
а) какова массовая доля КС1 в полученном растворе, если его масса после упаривания составляет 150 г;
б) массу испарившейся воды, если массовая доля КС1 повысилась до 25 %.
Решение. а) Учитывая, что содержание КС1 в растворе при упаривании не изменилось, из выражения (4.1) находим массу вещества:
т(вещества) = w×m(pacmвopa); т(вещества) =200×0,15 = 30 г.
Из выражения (4.1) находим массовую долю вещества в полученном растворе:
w(КС1)= = 0,2 = 20%.
= 0,2 = 20%.
б) Пусть испарилось х г воды, тогда из уравнения (4.1), выражающего массовую долю, находим:
 .
.
Найдем х = 80.
Ответ: а) 20 %; б) 80 г.
Пример 6. Какую массу соли СаС12 нужно добавить к 100 см3 раствора (р = 1,02 г/см3) с массовой долей этой соли 5 %, чтобы получить раствор с массовой долей 7,5 %?
Решение. Пусть нужно добавить х г соли. Используя формулу (4.1), составим уравнение, выражающее массовую долю СаС12 в растворе:
 Откуда х = 2,76.
Откуда х = 2,76.
Ответ: 2,76 г.
Смешивание растворов
Пример 7. Есть два раствора серной кислоты. Один с массовой долей H2SO4 60 % и плотностью 1,5 г/см3, второй - с массовой долей H2SO4 30 % и плотностью 1,22 г/см3. Определите:
а) какова будет массовая доля H2SO4, если смешать по 100 см3 этих растворов;
б) какой объем раствора с массовой долей H2SO4 30 % нужно добавить к 200 см3 раствора с h>(H2SO4) = 60 %, чтобы в полученном растворе массовая доля H2SO4 составляла 40 %.
Решение. а) Массовая доля H2SO4 в растворе, полученном при смешивании, будет равна:
w3(H2SO4) = w1 (H2SO4) + w2(H2SO4).
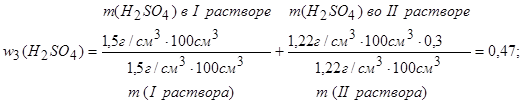
б) Пусть нужно взять V2 см3 раствора с w(H2SO4) = 30 %, тогда уравнение (4.1), выражающее массовую долю H2SO4 в конечном растворе, примет вид:
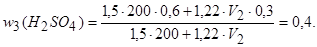
Откуда V2 = 491,8 см3.
Ответ: а) 47 %; б) 491,8 см3.
Расчеты с кристаллогидратами. Кристаллогидрат содержит воду, которая при приготовлении водных растворов становится частью растворителя. Другими словами, при растворении CuSO4×5H2O (или другого кристаллогидрата) в воде получается раствор CuSO4 в воде, а не раствор CuSO4×5H2O в воде.
Пример 8. Какие массы медного купороса и воды надо взять для приготовления 500 г раствора с массовой долей CuSO4 16 %? Какой станет массовая доля CuSO4, если к полученному раствору добавить 25 г CuSO4 ×5H2O?
Решение. М(CuSO4×5H2O) = 160 + 90 = 250 г/моль.
В конечном растворе должно содержаться:
т(вещества) = 500 г×0,16 = 80 г CuSO4.
Вариант I
Пусть масса вещества CuSO4×5H2O -x г, тогда
в 250 г CuSO4×5H2O содержится 160 г CuSO4, а в х г - 80 г CuSO4.
Откуда х = = 125 г.
= 125 г.
Вариант II
Из выражения (4.1) находим массовую долю CuSO4 в CuSO4×5H2O:
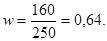
Если надо взять х г купороса, то w(CuSO4)= = 0,16 и х = 125 г.
= 0,16 и х = 125 г.
Из выражения (4.2) находим массу воды. Нужно взять т(растворителя) = 500 — 125 = 375 г.
Если добавить 25 г CuSO4×5H2O к полученному раствору, то массовая доля CuSO4 станет равной
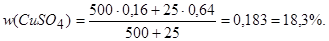
Ответ: 125 г купороса и 375 г воды; 18,3 %.
Массовая доля и концентрация вещества
Пример 9. Определите молярную концентрацию вещества (моль/дм3) в растворе с массовой долей фосфорной кислоты 60,8 % (р = 1,43 г/см3).
Решение. М(Н3РО4) = 98 г/моль.
Вариант I
Массу вещества выражаем из формулы (4.1):
т(вещества) = w×m(pacmвopa).
Объем раствора равен:
V(раствора) = т(раствора)/р(раствора).
Значения массы вещества и объема раствора подставим в выражение (4.5):
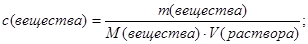
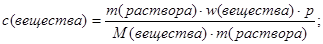
Масса раствора постоянна, она сокращается и мы получаем следующее выражение:
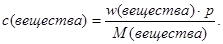
Подставляем значения:
c(H2SO4) =  = 0,00887 моль/см3 = 8,87 моль/дм3. 98
= 0,00887 моль/см3 = 8,87 моль/дм3. 98
Вариант II
Найдем массу Н3РО4 в 1 дм3 раствора.
Масса 1 дм3 раствора:
т(раствора) = 1,43 г/см3×1000 см3= 1430 г.
В 100 г раствора содержится 60,8 г Н3РО4,
в 1430 г раствора содержится х г Н3РО4.
Откуда х= =869,4 г.
=869,4 г.
В 1 дм3 раствора содержится n(Н3РО4) = = 8,87 моль
= 8,87 моль
кислоты, значит, с = 8,87 моль/дм3.
Ответ: 8,87 моль/дм3.
Пример 10. Найти массовую долю вещества в растворе с концентрацией КОН 1,6 моль/дм3. Плотность раствора 1,075 г/см3.
Решение. Вариант I
В 1 дм3 раствора массой т(раствора) = 1,075×1000 = 1075 г содержится 1,6 моль или т(вещества) = 1,6×56 = 89,6 г КОН.
В 1075 г раствора содержится 89,6 г КОН,
в 100 г раствора - х г КОН.
Откуда х =  = 8,33. Значит, w(KOH) = 8,33 %.
= 8,33. Значит, w(KOH) = 8,33 %.
Вариант II
Если составить уравнение, выражающее массовую долю, то для 1 дм3 раствора получим:
w(КОН)= = 0,0833 = 8,33 %
= 0,0833 = 8,33 %
Ответ: 8,33 %.
Пример 11. Соотношение между молекулами метанола и воды в растворе составляет 1:4. Определите массовую, объемную доли и концентрацию СН3ОН (моль/дм3) в растворе, если плотности составляют: СН3ОН - 0,79 г/см3, Н2О - 1,0 г/см3 (считать объем смеси равным сумме объемов компонентов).
Решение. Соотношение между молекулами такое же, как между количествами веществ, т. е. на 1 моль спирта приходится 4 моль воды.
Пусть раствор содержит 1 моль СН3ОН и 4 моль Н2О (можно рассмотреть 4 моль СН3ОН и 16 моль Н2О и т. д.). Тогда
m(CH3OH)=1×32=32 г, m(H2O)=4×18=72 г,
а из выражения (4.1):
 = 0,308.
= 0,308.
Объем СН3ОН, необходимый для приготовления раствора,
 = 40,5 см3,
= 40,5 см3,
объем воды V(растворителя) =  = 72 см3.
= 72 см3.
По условию, объем раствора равен сумме объемов компонентов, тогда из выражения (4.3):
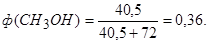
В 112,5 см3 раствора содержится 1 моль СН3ОН,
в 1000 см3 раствора - х моль СН3ОН.
... , ,
Откуда х = = 8,89 моль, т. е. с = 8,89 моль/дм .
= 8,89 моль, т. е. с = 8,89 моль/дм .
Ответ. w(CH3OH) = 30,8 %; ф(СН3ОН) = 36 %; с(СН3ОН) = 8,89 моль/дм3.
Растворимость веществ. Под растворимостью понимают способность вещества растворяться в том или ином растворителе. Растворимость - это предельное содержание вещества в растворе, выше которого раствор теряет гомогенность, т. е. перестает быть раствором по определению, растворимость обозначается s = с (насыщенный раствор), где с - концентрация вещества (молярная концентрация) в насыщенном растворе, единица СИ - моль/м3. До сих пор растворимость часто приводят в граммах растворенного вещества на 100 г или 1 дм3 растворителя.
Отнесение массы растворенного вещества к массе или объему растворителя, а не раствора, как в иных случаях выражения состава (w, ф, с), составляет особенность расчетов, связанных с растворимостью.
Пример 12. Растворимость нитрата калия в воде при температуре 293 К 16 г в 1 дм3. Определите:
а) какую массу соли надо растворить в 250 см3 воды для получения насыщенного раствора;
б) какой объем воды необходим для растворения 200 г соли;
в) какие массы воды и соли нужно взять для приготовления 300 г насыщенного раствора;
г) какова массовая доля соли в насыщенном растворе.
Решение. а) 316 г соли растворяется в 1000 см3 воды, х г- в 250 см3.
х = = 79 г.
= 79 г.
б) 316 г соли растворяется в 1000 см3 воды, 200 г - в х см.
В лекции "40 Среднеарифметическая и среднеквадратичная скорости движения молекул" также много полезной информации.
х= = 632,9 см .
= 632,9 см .
в) (1000 + 316) г насыщенного раствора содержат 316 г соли. 300 г - х г.
х = = 72 г соли.
= 72 г соли.
Значит, нужно взять 300 - 12 = 228 г воды.
Г)  = 24%.
= 24%.
Ответ: а) 79 г; б) 632,9 см3; в) 72 г соли и 228 г воды; г) 24 %.




















