Лекции по физике. Термодинамика (1019842), страница 2
Текст из файла (страница 2)
Итак, согласно (14) давление на стенки сосуда определяется произведением концентрации молекул n на их среднюю кинетическую энергию поступательного движения <Wк>.
1.4. Молекулярно-кинетическое толкование термодинамической температуры Учитывая, что n=N/V=NA(m/M)/V, где V - объем газа, перепишем (14) в виде ![]() . (15)
. (15)
С другой стороны согласно уравнению Клапейрона-Менделеева РV=(m/M)RT = (m/M)NAkT. Таким образом
Итак, термодинамическая температура с точностью до постоянного множителя (3/2)k равна средней кинетической энергии поступательного движения молекулы.
Таково молекулярно-кинетическое толкование термодинамической температуры.
средний квадрат скорости молекул газа, из (16) находим среднюю квадратичную скорость <vKB>=![]() . (18)
. (18)
Например, при t=27 C или T=300 K молекулы кислорода (М=32∙10-3 кг/моль) имеют скорость <vKB>=483 м/c.
1.5. Барометрическая формула. Распределение Больцмана
При выводе уравнения (14) предполагалось, что на молекулы газа внешние силы не действуют, поэтому молекулы равномерно распределены по объему. Однако молекулы газа находятся в поле тяготения Земли, поэтому их концентрация с высотой уменьшается. Покажем это.

dP= -gdh. (19)
Воспользовавшись уравнением Клапейрона-Менделеева РV=![]() RT , находим, что
RT , находим, что ![]() . Подставив это выражение в (19), получим
. Подставив это выражение в (19), получим
Интегрируя (20) от h=0 до h находим, ![]() .Проведя потенцирование получим барометрическую формулу.
.Проведя потенцирование получим барометрическую формулу. ![]() , (21)
, (21)
где m0=M/NA, k=R/NA.
Эта формула была впервые установлена в 1821 г. Лапласом.
Анализ барометрической формулы (21) показывает, что чем больше молярная масса М газа, тем быстрее его давление убывает с высотой. Поэтому атмосфера по мере увеличения высоты все более обогащается легкими газами.
Следует иметь в виду, что применимость формулы (21) к реальной атмосфере несколько ограничена, поскольку атмосфера в действительности не находится в тепловом равновесии, и ее температура меняется с высотой. Тем не менее, ее используют, определяя высоту по изменению давления.
Формулу (21) можно преобразовать, если воспользоваться выражением (9) Р=nkT
где m0gh=Wп - потенциальная энергия молекулы в поле тяготения, т.е.
Больцман доказал, что формула (21) справедлива в случае потенциального поля любой природы (т.е. не только поля тяготения). В связи с этим функцию (23) называют распределением Больцмана.
-
Закон Максвелла о распределении молекул идеального газа по скоростям
В газе, находящемся в состоянии равновесия, установится некоторое стационарное (не меняющееся со временем) распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону. Такой закон был теоретически выведен Максвеллом в 1859 г. и был опубликован в 1860 г.
При выводе этого закона Максвелл предполагал, что газ состоит из очень большого числа N тождественных молекул, находящихся в состоянии беспорядочного теплового движения при одинаковой температуре. Предполагалось также, что внешние поля на газ не действуют.
Закон Максвелла описывается некоторой функцией f(v), называемой функцией распределения молекул по скоростям. Различают три формы записи распределения Максвелла. Мы изучим одну из них.
1.6.1. Распределение Максвелла по модулю скорости молекул
Обозначим через dNv число молекул, скорости которых лежат в интервале от v до v+dv, тогда dNv/N – характеризует относительное число этих молекул. Принято вводить функцию распределения молекул по скоростям
Максвелл показал, что эта функция имеет вид
Функция ![]() характеризует плотность вероятности того, что скорость молекулы равна v, и поэтому эта функция удовлетворяет условию нормировки
характеризует плотность вероятности того, что скорость молекулы равна v, и поэтому эта функция удовлетворяет условию нормировки
И
Рис. 4.
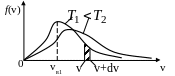 спользуя функцию распределения, можно найти относительное число молекул N/N, скорости которых лежат в интервале от v1 до v2
спользуя функцию распределения, можно найти относительное число молекул N/N, скорости которых лежат в интервале от v1 до v2 Анализ (24) показывает, что вид функции зависит от массы молекулы m0 и от температуры Т.
На рис.4 представлен вид функции f(v) для двух температур. Характерно, что f(v), начинаясь от нуля, достигает максимума при vВ и затем асимптотически стремится к нулю.
Относительное число молекул dNV/ N , скорости которых лежат в интервале от v до v+dv находится как площадь dS заштрихованной полоски на рис. 4. Площади, ограниченные кривыми, согласно (26), одинаковы и равны единице.
Скорость, при которой функция распределения молекул по скоростям максимальна, называется наиболее вероятной скоростью vB. Исследование (24) на максимум позволило найти наиболее вероятную скорость молекул
Из формулы (28) следует, что при повышении температуры максимум f(v) сместится вправо, в сторону больших скоростей.
Кроме наиболее вероятной и средней квадратичной скорости молекул газа, которые определяются по формулам (28) и (18), используется также средняя скорость молекул <v> или средняя арифметическая скорость. Она определяется по формуле
Подставляя f(v) [cм.(24)] и интегрируя , получим
Итак существуют три формулы для определения скорости молекул газа: (18), (28), (30). Согласно этим формулам
vB<v> <vKB>=![]()
![]()
![]() =1 1,13 1,22. (31)
=1 1,13 1,22. (31)
Таким образом, средняя и средняя квадратичная скорости превышают наиболее вероятную скорость на 13 и 22 % соответственно, т.е. отличие не очень большое.
Исходя из распределения молекул по скоростям (24), можно найти распределение молекул газа по кинетическим энергиям поступательного движения молекул Wк=m0v2/2. Это распределение характеризуется функцией f(Wк), которая вводится аналогично f(v)
-
Распределение Максвелла-Больцмана
В 1866 г. Больцман (1844-1906 г.) вывел более общее распределение, включающее распределение Максвелла, которое называется распределением Максвелла-Больцмана
где ![]() - импульс частицы, в частности молекулы газа,
- импульс частицы, в частности молекулы газа, ![]() - радиус-вектор, характеризующий положение частицы, p2/2m0=Wк – кинетическая энергия частицы,
- радиус-вектор, характеризующий положение частицы, p2/2m0=Wк – кинетическая энергия частицы, ![]() - потенциальная энергия частицы.
- потенциальная энергия частицы.
Распределение (33) можно записать в виде распределения по полной энергии Е частиц
f(E)=Aexp(-E/kT), (34)
где E=Wк+Wп - полная энергия частицы.
-
Среднее число столкновений и средняя длина свободного пробега молекул
Молекулы газа, находясь в состоянии хаотического движения, непрерывно сталкиваются друг с другом.
Между двумя последовательными столкновениями молекулы проходят некоторое расстояние , которое называется длиной свободного пробега молекул.
Эти расстояния могут быть самыми разными. Поэтому в кинетической теории вводится понятие средней длины свободного пробега молекул <>.
При вычислении <> необходимо принять определенную модель газа. Будем считать, что молекулы представляют собой шарики некоторого диаметра d порядка 10-10 м, зависящего от природы газа.
Двигаясь со средней скоростью <v>, молекула столкнется только с теми молекулами, центры которых находятся в цилиндре радиуса d.
Среднее число столкновений <z>, которое испытает молекула с другими неподвижными молекулами за время t, будет равно числу молекул внутри цилиндра, диаметр которого 2d и длина <v>t, т.е. <z>=d2<v>tn, где n - концентрация молекул.
Расчеты показывают, что при учете движения других молекул
Тогда средняя длина свободного пробега молекул
т.е. обратно пропорциональна концентрации молекул (или давлению P т. к., Р=nkT). Можно показать, что при нормальных условиях < > ≈ 10-7 м и число столкновений за 1 секунду < z> /t≈1010 c-1.
Лекция 3. Явления переноса
До сих пор мы рассматривали исключительно равновесные системы, характеризующиеся при постоянных внешних условиях неизменностью параметров (Р, V, T, ) во времени и отсутствием в системе потоков вещества, энергии, импульса.
Однако, беспорядочность теплового движения молекул газа, непрерывные столкновения между ними приводят к постоянному перемешиванию частиц и изменению их скоростей и энергий. Если в газе существует пространственная неоднородность плотности, температуры, скорости упорядоченного перемещения отдельных слоев, то происходит самопроизвольное выравнивание этих неоднородностей. В газе возникают потоки вещества, энергии, импульса упорядоченного движения молекул.
Эти потоки, характерные для неравновесных состояний газа, являются физической основой особых процессов, объединенных общим названием ”явления переноса ”. К этим явлениям относятся диффузия, теплопроводность и внутреннее трение. Для простоты ограничимся одномерными явлениями переноса. Систему отсчета выберем так, чтобы ось х была ориентирована в направлении переноса

















