Материальный баланс процесса абсорбции
Материальный баланс процесса абсорбции
Схема противоточного процесса:

 ,
, 
 ,
,  G – расход газовой фазы, кмоль/с;
G – расход газовой фазы, кмоль/с;
L – расход жидкой фазы, кг/с
газовая фаза
 ,
,  равновесие в системе
равновесие в системе
жидкая фаза
 ,
, 
 ,
, 
Рекомендуемые материалы
Материальный баланс составляют для определения количества компонента, кмоль/с, которое перейдет из газовой фазы в жидкую при отсутствии равновесия между фазами, т. е.
 ;
;
где:  ,
,  - количество входящего и выходящего из абсорбера газа, кмоль/с (кмоль/ч);
- количество входящего и выходящего из абсорбера газа, кмоль/с (кмоль/ч);
 ,
,  - количество входящего и выходящего абсорбента, кмоль/с (кмоль/ч);
- количество входящего и выходящего абсорбента, кмоль/с (кмоль/ч);
 ,
,  - мольные доли газового компонента на входе и на выходе из аппарата, кмоль/кмоль;
- мольные доли газового компонента на входе и на выходе из аппарата, кмоль/кмоль;
 ,
,  - мольные доли жидкого компонента на входе и на выходе из аппарата, кмоль/кмоль;
- мольные доли жидкого компонента на входе и на выходе из аппарата, кмоль/кмоль;
Так как расходы газа и жидкости в процессе абсорбции не изменяются, то уравнение может принять вид:
 ,
,
если ввести индекс 1- вместо  , а 2- вместо
, а 2- вместо  , то уравнение примет вид:
, то уравнение примет вид:
 .
.
Тогда минимальный расход абсорбента будет равен:
 , а отношение
, а отношение 
 - удельный расход абсорбента, кмоль/кмоль. Или
- удельный расход абсорбента, кмоль/кмоль. Или
 , отсюда
, отсюда  - линейная зависимость, поэтому необходимый расход абсорбента принимаем с запасом 1,2 – 1,3.
- линейная зависимость, поэтому необходимый расход абсорбента принимаем с запасом 1,2 – 1,3.
Уравнение материального баланса можно выразить графически, приняв концентрации газа и жидкости в относительных мольных долях.
Из уравнения  видно, что концентрация газа в абсорбере изменяется линейно, поэтому рабочая линия представляет собой прямую с углом наклона, тангенс которого равен
видно, что концентрация газа в абсорбере изменяется линейно, поэтому рабочая линия представляет собой прямую с углом наклона, тангенс которого равен  , а относительная концентрация компонента
, а относительная концентрация компонента
 , кмоль/кмоль, (кг/кг);
, кмоль/кмоль, (кг/кг);  .
.
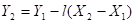
По закону Генри  ,
,
где  - константа фазового равновесия, тогда:
- константа фазового равновесия, тогда:

Состояние равновесия между концентрацией газа в газовой и жидкой фазах характеризуется константой фазового равновесия (коэффициентом распределения), которая равна отношению концентрации компонента в газовой фазе к его концентрации в жидкой фазе.
В зависимости от способа выражения концентраций, константа фазового равновесия может быть определена:
 ,
,  ;
; 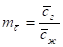
 ;
;  , Па/мольные доли
, Па/мольные доли
 ,
,  ;
;  ,
,  .
.
Сведения о растворимости газов  , определенные опытным путем, приведены в справочниках:
, определенные опытным путем, приведены в справочниках:
1. Коган В.Б., Фридман В.М. Равновесие между жидкостью и паром, 1966 г.
2. Павлов К.Ф., Носков А.А. Примеры и задачи по курсу процессы и аппараты химической технологии.
В технологических расчетах могут быть применимы законы для идеальных растворов:
а) закон Рауля – при температурах ниже критических:
 ,
,
где:  - парциальное давление компонента в газовой фазе над жидкостью в условиях равновесия;
- парциальное давление компонента в газовой фазе над жидкостью в условиях равновесия;
 - давление насыщенного пара чистого компонента А при данной температуре;
- давление насыщенного пара чистого компонента А при данной температуре;
 - мольная доля компонента А в жидкой фазе.
- мольная доля компонента А в жидкой фазе.
б) закон Генри - для систем “жидкость - газ” при температурах газа выше критических, когда концентрация растворенного компонента мала ( менее 10%), а температура и давление далеки от критических значений:
 ,
,  ,
,  ,
,
где:  - парциальное давление компонента в газовой фазе над жидкостью в условиях равновесия;
- парциальное давление компонента в газовой фазе над жидкостью в условиях равновесия;
 - мольная доля компонента в жидкой фазе;
- мольная доля компонента в жидкой фазе;
 - коэффициент Генри, изменяется с температурой и зависит от природы газа и растворителя, имеет размерность давления (Павлов К.Ф., табл. XLII).
- коэффициент Генри, изменяется с температурой и зависит от природы газа и растворителя, имеет размерность давления (Павлов К.Ф., табл. XLII).
Так как  , то уравнение
, то уравнение  можно представить в виде
можно представить в виде
 ;
;  ;
;  ;
;
где: - мольная доля компонента в газовой фазе, равновесной с жидкой;
- мольная доля компонента в газовой фазе, равновесной с жидкой;
 - безразмерная константа фазового равновесия, постоянная при
- безразмерная константа фазового равновесия, постоянная при  -const и
-const и  -const.
-const. 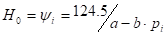
 ,
,  - коэффициенты зависящие от температуры;
- коэффициенты зависящие от температуры;
 - парциальное давление в газе, Мпа.
- парциальное давление в газе, Мпа.
Если концентрация в  в
в  , то:
, то:
 , подставим это выражение в уравнение
, подставим это выражение в уравнение  ;
;
 .
.
Закон Генри:  .
.  - в справочной литературе,
- в справочной литературе,  .
.
Зная  (спр.), вычисляют равновесное содержание абсорбируемого компонента в газовой фазе:
(спр.), вычисляют равновесное содержание абсорбируемого компонента в газовой фазе:
 , тогда закон Генри можно записать как:
, тогда закон Генри можно записать как:
 , где
, где  .
.
Если концентрация компонентов выражена в относительных мольных концентрациях, то тогда закон Генри примет вид:
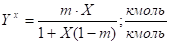
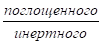
 ;
;
Если концентрация компонентов выражена в относительных массовых концентрациях, то тогда закон Генри примет вид:
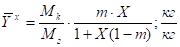
 .
.
Если в газовой смеси присутствует лишь 1 компонент, то  .
.
Для газов, близких к идеальным, мольная доля численно равна объемной доле (С) и на основании уравнения Клайперона:  , а условие равновесия “газ - жидкость” может быть выражено законом Рауля:
, а условие равновесия “газ - жидкость” может быть выражено законом Рауля:  .
.
Равновесие при физической абсорбции можно выразить с помощью закона Генри в области малых концентрациях и при температурах ниже критических (меньше 10%), устанавливающим зависимость между растворимостью газа и его парциальным давлением.:
 ; или
; или 
где:  - равновесное парциальное давление компонента в газе, Па;
- равновесное парциальное давление компонента в газе, Па;
 - коэффициент Генри (в справочной литературе, зависит от температуры, природы газа и растворителя);
- коэффициент Генри (в справочной литературе, зависит от температуры, природы газа и растворителя);
 - мольная доля компонента в жидкости.
- мольная доля компонента в жидкости.
Зависимость константы Генри от температуры определяют из выражения:
 ;
;
где:  ,
,  - коэффициенты при
- коэффициенты при  ,
,  ,
,  ;
;
 - парциальное давление компонента в газовой фазе, Мпа:
- парциальное давление компонента в газовой фазе, Мпа:
 .
.
Так как растворимость многих газов значительно отклоняется от закона Генри, то при расчетах можно использовать экспериментальные опытные данные парциального давления:
 или используют таблицы растворимости газов (Павлов К.Ф., Носков А.А. Примеры и задачи по курсу процессы и аппараты химической технологии).
или используют таблицы растворимости газов (Павлов К.Ф., Носков А.А. Примеры и задачи по курсу процессы и аппараты химической технологии).
Кинетика процесса абсорбции
При отсутствии равновесия между фазами происходит переход вещества из одной фазы в другую. Скорость этого процесса:
 ;
;
где:  - масса вещества , переходящей из одной фазы в другую в единицу времени, кмоль/ч (кг/ч);
- масса вещества , переходящей из одной фазы в другую в единицу времени, кмоль/ч (кг/ч);
 - поверхностный коэффициент массопредачи, отнесенный к концентрации газа;
- поверхностный коэффициент массопредачи, отнесенный к концентрации газа;
 - поверхность соприкосновения фаз,
- поверхность соприкосновения фаз, 
 - средняя движущая сила процесса.
- средняя движущая сила процесса.
Процесс массопередачи протекает в две стадии:
1) перенос вещества из газовой фазы к поверхности соприкосновения фаз;
2) перенос вещества от поверхности раздела в жидкую фазу.
 ;
;  ;
;
где:  ,
,  - коэффициенты массоотдачи в газовой и жидкой фазах;
- коэффициенты массоотдачи в газовой и жидкой фазах;
 - константа фазового равновесия.
- константа фазового равновесия.
Из приведенных уравнений видно, что общее сопротивление массопередаче зависит не только от коэффициента массоотдачи, но и в большей степени от константы фазового равновесия  :
:
- при  - хорошо растворимые газы, тогда:
- хорошо растворимые газы, тогда:  .
.
Член  очень мал, и им можно пренебречь, это значит, что сопротивление жидкой фазы незначительно.
очень мал, и им можно пренебречь, это значит, что сопротивление жидкой фазы незначительно.
- при - плохо растворимые газы – сопротивлением газовой фазы можно пренебречь, основное сопротивление в жидкой фазе и тогда:
- плохо растворимые газы – сопротивлением газовой фазы можно пренебречь, основное сопротивление в жидкой фазе и тогда:  .
.
- при  - умеренно растворимые газы и здесь требуется учитывать
- умеренно растворимые газы и здесь требуется учитывать  и
и  .
.
Эти значения определяются экспериментально с использованием критериального уравнения:  ,
,
где:  ;
;
 ;
;
 .
.
Бесплатная лекция: "3 Ультразвуковая диагностическая аппаратура" также доступна.
 - симплекс геометрического подобия;
- симплекс геометрического подобия;
коэффициенты  ,
,  ,
,  ,
,  - экспериментальные;
- экспериментальные;
 - линейный размер;
- линейный размер;
 - коэффициент кинематической вязкости;
- коэффициент кинематической вязкости;
 - скорость газа;
- скорость газа;
 - коэффициент диффузии.
- коэффициент диффузии.






















