Электродные потенциалы. Гальванический элемент
Глава 6. ЭЛЕКТРОХИМИЯ МЕТАЛЛОВ
6.1. Электродные потенциалы. Гальванический элемент
Металлы составляют большую часть таблицы Д.И.Менделеева. Наиболее распространенными являются: Al – 7,45%, Fe – 4,2%, Ca – 3,25%, Na – 2,4%, Mg – 2,35%, K – 2,35%.
Все характерные свойства металлических твердых тел обусловлены Природой металлов, особенностью химической связи и строением кристаллической решетки. Для металлических твердых тел характерны высокая теплопроводность, электропроводность, пластичность, деформируемость, высокая плотность, а также способность терять электроны – восстановительная активность.
Величиной, характеризующей восстановительную способность металлических твердых тел, а также окислительные свойства ионов металлов в водных растворах, является электродный потенциал, который обозначается j и измеряется в вольтах (В).
Электрод – это в данном случае металл, в твердом состоянии, погруженный в воду или в водный раствор своей соли. Электродный потенциал (jМе) описывается общим уравнением на его границе с окружающей средой: Ме – ne + mH2O«Меn+.mH2O – гидратированный ион металла. Стандартным электродным потенциалом (jо) называют электродный потенциал металла, возникающий при погружении его в раствор соли собственного иона с активностью (или концентрацией), равной 1 молю на литр (1 моль/литр), измеренный по сравнению со стандартным водородным электродом, потенциал которого при Т = 293 К и Р = 1,01 * 105 Па условно принимается равным 0 (jо = 0, DGо = 0). Стандартные электродные потенциалы описывают процесс равновесия описывают процесс равновесия Ме – ne = Меn+; являются характеристикой окислительно-восстановительного равновесия и характеризуют природу металла. Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов (jо), получаем ряд напряжений, который дает следующую информацию (прил. 4):
- чем более отрицательное значение потенциала, тем более активен металл, тем легче он окисляется;
- чем более положительное значение потенциала, тем легче идет восстановление иона металла;
Рекомендуемые материалы
- каждый вышестоящий металл способен вытеснять нижестоящий из раствора его соли.
Зависимость электродного потенциала от концентрации веществ выражается уравнением Нернста:

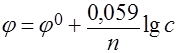
где j0 – стандартный электродный потенциал; n – число электронов, принимающих участие в процессе каждым атомом или ионом; с – концентрация (при точных вычислениях – активность) гидратированных ионов металла в растворе, моль/л.
Пример 1. Стандартный электродный потенциал никеля больше, чем кобальта (прил. 5). Изменится ли это соотношение, если измерить потенциал никеля в растворе с концентрацией 0,0001 моль/л?
Решение. Стандартные электродные потенциалы металлов для Ni и Co соответственно равны –0,25 и –0,277 В. Определим электродные потенциалы этих металлов при данных в условии концентрациях:
jNi2+/Ni = 0,25 + 0,059/2lg10-3 = -0339 B
jCo2+/Co = -0,277 + 0,059/2lg10-3 = -0,307 В
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Электродные потенциалы и их значение являются характеристиками химических источников постоянного электрического тока (ХИЭТ): гальванических элементов, аккумуляторов и др. ХИЭТ устроены таким образом, что позволяют окислительно-восстановительную реакцию, лежащую в основе работы гальванического элемента, превратить в электрическую энергию.
Для возникновения тока необходимо, чтобы между электродами была разность в значениях потенциалов. Разность потенциалов может быть достигнута использованием либо электродов разной природы, либо электродов одной природы при разных концентрациях растворов солей. В последнем случае элемент называют концентрационным.
Всякий гальванический элемент состоит из двух электродов-металлов, погруженных в растворы электролитов, разделенных пространственной или полупроницаемой перегородкой. Более отрицательный по значению потенциала электрод, на котором в ходе реакции происходит процесс окисления, называют а н о д о м (анод заряжен отрицательно). Электрод с более положительным значением потенциала, на котором осуществляется процесс восстановления, называется к а т о д о м (катод заряжен положительно).Электродвижущая сила (ЭДС) гальванического элемента может быть представлена как разность двух электродных потенциалов – катода (jк) и анода –(jа): ЭДС = jк - jа.
Пример 2. В гальваническом элементе электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 0,1 моль/л. Какой металл является анодом, какой – катодом? Написать уравнения окислительно-восстановительной реакции, протекающей в гальваническом элементе, и вычислить его ЭДС.
Решение. Стандартные электродные потенциалы (прил. 4) для Mg и Zn равны соответственно –2,37 и –0,76 В. По уравнению Нернста определим электродные потенциалы этих металлов при данных условиях и концентрациях: jMg2+/Mg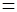
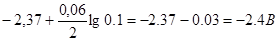
jZn2+/Zn=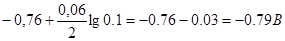
Так как магний имеет меньший потенциал (более отрицательный), то он является анодом, на котором протекает окислительный процесс:
Mgо – 2e = Mg2+
Цинк, имеющий более высокое значение потенциала – катод, т.е. электрод, на котором протекает восстановительный процесс:
Zn2+ + 2e = Znо.
Вычисляем ЭДС гальванического элемента:
ЭДС(Е) = jZn - jMg = -0,79 – (-2,4) = 1,61 В.
Вместе с этой лекцией читают "Лекция 14".
Пример 3. Гальванический элемент состоит из стандартного водородного электрода и водородного электрода, погруженного в раствор с pH = 12.На каком электроде водород будет окисляться при работе гальванического элемента, на каком – восстанавливаться? Рассчитать ЭДС элемента.
Решение. Потенциал стандартного водородного электрода на котором осуществляется процесс 2H+ + 2e = H2 при активности (концентрации) ионов водорода, равной 1 (pH = 0), считается равным 0: j1 = 0 (при 25оС). При изменении концентрации (активности) ионов водорода в растворе потенциал водородного электрода определяется выражением, вытекающим из уравнения Нернста:
j = -0,059 pH,
т.е. для данного в условии значения pH раствора потенциал водородного электрода
j2 = -0,059 * 12 = -0,708 В.
Судя по рассчитанной величине j2, на этом электроде будет идти процесс окисления водорода: H2 – 2e = 2H+, т.е. он будет служить анодом. Находим ЭДС элемента: Е = j1 - j2 = 0,708 В.





















