Реальные газы
Реальные газы.
Реальные газы плохо описываются уравнением состояния идеального газа, причем наибольшие отклонения от идеальности наблюдаются в области высоких давлений и низких температур. Это связывают с увеличением влияния на свойства систем собственного объема молекул газа: во- первых, объем молекул газа становится соизмерим с общим объемом системы, а во-вторых, начинают проявляться силы межмолекулярного притяжения ( в связи с чем, давление сжатых газов меньше рассчитанных величин).

Для того, чтобы уравнение состояния ИГ могло использоваться в приближенных расчетах, было предложено ввести поправочные коэффициенты: один коэффициент Dр компенсирует уменьшение давления из-за межмолекулярного притяжения, коэффициент В – учитывает эффективный объем молекул реального газа. Тогда:
[р+Dр]*(V-В) = RT
Если величина Dр определяется силами межмлк притяжения, то ее величина будет определяться как произведение количества притягиваемых молекул n, количества молекул притягивающих N и силы притяжения k:
Dр = nNk
Если предположить, что молекулы газа находятся в упорядоченном состоянии, соответствующем плотнейшей упаковке, то величины n и N будут равны, тогда:
Dр = n2k
Рекомендуемые материалы
А если учесть, что количество молекул n обратно пропорционально объему V, то можно записать:
Dр = k/V2
Тогда уравнение состояния реального газа будет выглядеть:
[р+k/V2]*(V-В) = RT уравнение Ван-дер-Ваальса
Величина k/V2 называется внутренним давлением и значительно зависит от плотности вещества и его строения. Для жидкостей величина внутреннего давления может достигать нескольких тысяч атмосфер: вода – 14700 атм, бензин ~3800 атм. Из этого примера видно, что с ростом полярности жидкости величина внутреннего давления также растет.
Представленное уравнение Ван-дер-Ваальса применимо лишь для приблизительного расчета, т.к. используемые коэффициенты не учитывают ни строения вещества, ни сложный характер зависимости сил межмолекулярного притяжения от расстояния. Все эти параметры учитываются в специальных вириальных уравнениях (от лат. Vires – сила).
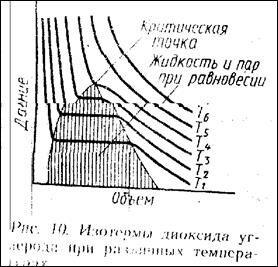
Явление межмолекулярного притяжения в газах приводит к возникновению понятий критических постоянных и критической точки газа. При высоких температурах межмолекулярное притяжение мало влияет на поведение газа и зависимость р–V близка к выполнению закона Бойля-Мариотта. При понижении температуры внутренняя энергонасыщенность молекул газа (колебательное, вращательное движение) снижается настолько, что силы притяжения способны фиксировать молекулы друг возле друга, создавая ближний порядок – т.е. упорядоченное состояние вещества в микрообъеме (размером в несколько молекул). Ближний порядок характерен для жидкостей, т.о. газ конденсируется в жидкость. Этой точке соответствует точка кипения вещества, но достичь этого состояния можно и при температурах гораздо более высоких, чем Ткип путем изменения давления и объема. Однако величина внутреннего энергозапаса молекул газа (внутренняя энергия) должна быть ниже определенного уровня. В результате на изотерме газа появляется область аномального поведения. Горизонтальное положение изотерм внутри этой области соответствует жидкости. Верхняя точка купола соответствует особенной критической точке – в этой точке существует лишь одна фаза, не являющаяся ни жидкостью, ни газом. Каждый газ характеризуется индивидуальной критической точкой, которой соответствуют критические температура, давление и объем. Выше критической температуры газ ни при каких условиях не может быть сжижен.
| Газ | Критические константы газов | Численные величины констант ур-я Ван-дер-Ваальса | |||
| Ткрит, К | ркрит*105Па | Vкрит.м3/кмоль | k | В*102 | |
| Водород | 33,2 | 12,9 | 65 | 0,245 | 2,67 |
| Азот | 126,0 | 33,9 | 90 | 1,38 | 3,94 |
| Кислород | 154,3 | 50,3 | 74,5 | 1,32 | 3,12 |
| СО | 133,0 | 34,9 | 93 | 1,49 | 4,00 |
| NH3 | 405,5 | 112,9 | 72,4 | 4,0 | 3,6 |
| СL2 | В лекции "Развитие науки" также много полезной информации. 417,1 | 77,0 | 124 | 5,5 | 4,9 |
Из приведенных данных видна жесткая зависимость между величиной k (коэффициент межмлк взаимодействия) и критической температурой. Кроме того видно, что только аммиак и хлор могут быть сжижены при обычных температурах.




















